
| A. | B的氢化物和E的氢化物能反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 五种原子中E的原子半径最大 | |
| D. | A的最低价氢化物的沸点>B的最低价氢化物的沸点 |
分析 短周期元素A、B、C、D、E的原子序数依次增大;A的一种核素在考古时常用来鉴定一些文物的年代,则A是C元素;
B的氢化物的水溶液呈碱性,则B为N元素;
C、D为金属元素,且D原子最外层电子数等于其K层电子数,其最外层电子数为2,所以D为Mg元素,而C的阳离子半径大于D的阳离子半径,且C原子序数大于B而小于D,所以C为Na元素;
若往E单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色的现象,则E是Cl元素;
A.B的氢化物的氨气、E的氢化物是HCl,二者反应生成氯化铵;
B.C是Na元素,其原子核外有3个电子层、最外层电子数是1,主族元素电子层数与其周期数相等、最外层电子数与其族序数相等;
C.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
D.A的氢化物是甲烷、B的氢化物是氨气,分子晶体熔沸点与分子间作用力成正比,且含有氢键的物质熔沸点较高.
解答 解:短周期元素A、B、C、D、E的原子序数依次增大;A的一种核素在考古时常用来鉴定一些文物的年代,则A是C元素;
B的氢化物的水溶液呈碱性,则B为N元素;
C、D为金属元素,且D原子最外层电子数等于其K层电子数,其最外层电子数为2,所以D为Mg元素,而C的阳离子半径大于D的阳离子半径,且C原子序数大于B而小于D,所以C为Na元素;
若往E单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色的现象,则E是Cl元素;
A.B的氢化物的氨气、E的氢化物是HCl,二者反应生成氯化铵,氯化铵中含有离子键和共价键,故A错误;
B.C是Na元素,其原子核外有3个电子层、最外层电子数是1,所以Na位于第三周期第IA族,故B正确;
C.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径最大的是C元素,故C错误;
D.A的氢化物是甲烷、B的氢化物是氨气,分子晶体熔沸点与分子间作用力成正比,且含有氢键的物质熔沸点较高,氨气相等分子质量大于甲烷且氨气中含有氢键,所以甲烷熔沸点低于氨气,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断能力,明确原子结构、元素周期表结构、物质结构及其性质是解本题关键,熟悉元素周期律并灵活运用,注意:氢化物稳定性与化学键有关、氢化物熔沸点与分子间作用力有关,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| B | 在KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变成蓝色 | KIO3的氧化性比I2强 |
| C | 向CH2=CHCH2OH中滴入酸性高锰酸钾溶液 | 紫红色褪去 | 证明CH2=CHCH2OH中含有碳碳双键 |
| D | 向Na2S溶液中加入酚酞,再滴加稀盐酸 | 溶液先变红,后红色变浅直至消失 | 证明非金属性:Cl>S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸溶液,NaAlO2溶液 | B. | 浓氨水,AgNO3溶液 | ||
| C. | NaOH溶液,AlCl3溶液 | D. | Cu,FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| C. | 检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可 | |
| D. | 除去FeCl3溶液中的FeCl2杂质可以向溶液中加入足量的铁粉,然后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 序号 | 初始浓度c/(mol•L-1) | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 1.60 | 0.40 | 0.0020 | 580 |
| ② | 3.20 | 0.40 | 0.0020 | 290 |
| ③ | 1.60 | 0.80 | 0.0020 | 290 |
| ④ | 1.60 | 0.40 | 0.0040 | 1160 |
| A. | 由①④实验对比,可以得出增大c(Br2),v(Br2)减小 | |
| B. | 由②③实验对比,可以得出实验②和③的v(Br2)相等 | |
| C. | 由①③实验对比,可以得出增大c(HCl),v(Br2)增大 | |
| D. | 由①②实验对比,可以得出增大c(CH3COCH3),v(Br2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
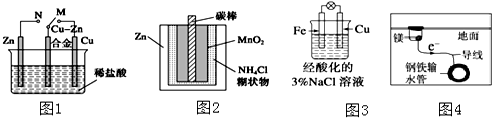
| A. | 图1中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | |
| B. | 图2中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 | |
| C. | 图3中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发结晶时,当加热至蒸发皿中有大量固体析出时应停止加热,利用余热蒸干剩余溶液 | |
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. | 将过氧化钠固体投入紫色石蕊溶液中,可看到石蕊溶液变蓝 | |
| D. | 用原子吸收光谱可以确定物质中含有哪些金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com