
【题目】在2A(g)+B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( )
A. v(A)=0.5molL﹣1.mim﹣1
B. v(B)=0.3molL﹣1.mim﹣1
C. v(C)=0.8molL﹣1.mim﹣1
D. v(D)=1.0molL﹣1.mim﹣1
【答案】B
【解析】试题比较化学反应速率时,首先看单位,题中所给的四个选项的单位相同,均为molL﹣1.min﹣1;再看是否是同一种物质表示的化学反应速率,四个选项所给的化学反应速率是用四种不同的物质表示的,则根据不同物质表示的化学反应速率的数值之比等于其化学计量数之比,可以四种不同的物质表示的化学反应速率转化为同种物质表示的化学反应速率,比如都转化成B物质表示的化学反应速率。A.v(B)=0.25molL﹣1.min﹣1;B.v(B)=0.3molL﹣1.min﹣1;C.v(B)=![]() molL﹣1.min﹣1;D.v(B)=0.25molL﹣1.min﹣1;再比较四个数值的大小,可知,B项的反应速率最快。故答案B。
molL﹣1.min﹣1;D.v(B)=0.25molL﹣1.min﹣1;再比较四个数值的大小,可知,B项的反应速率最快。故答案B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于密闭容器中进行的反应N2+O2![]() 2NO,下列条件能加快其反应速率的是( )
2NO,下列条件能加快其反应速率的是( )
A. 增大体积使压强减小 B. 压强不变,充入气体Ne
C. 体积不变,充入N2使压强增大 D. 体积不变,充入He使压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红。填空完成问题:
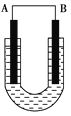
①A是原电池的_______极,代表金属____(填“铜”或“铁”);
②电极方程式分别为正极:______________________,原电池反应为_____________________________________。
(2)请从图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25 mL),并检验氯气的氧化性。
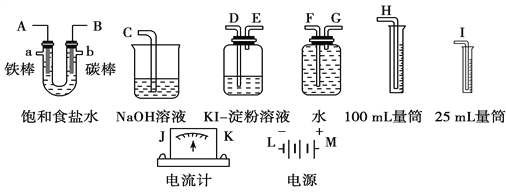
①A极发生的电极反应式是________________,B极发生的电极反应式是_______________。
②设计上述气体实验装置时,各接口的正确连接顺序为_________________________________________________________。
③实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)许多金属元素有焰色反应,金属存在焰色反应的原因是___________________________。
(2)基态铝原子中,有______种电子运动状态,其中p轨道的电子云轮廓图的形状为_______。
(3)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
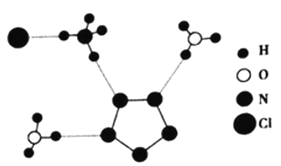
①图中R中阳离子是______(填写化学式),相对分子质量较大的阳离子中心原子的杂化类型是____。
②图中R中阴离子N5-中的σ键总数为___________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N5- 中的大π键应表示为___________。
),则N5- 中的大π键应表示为___________。
(4)氮与铝之间形成化合物X,具有耐高温抗冲击等性能。X的晶体结构如图所示。
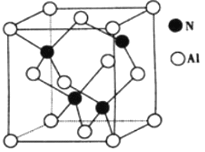
①已知氮化硼与X晶体类型相同,推测氮化硼的熔点比X的熔点___________(填“高”、“低“ ) ,可能的原因是_________________________________________。
②若X的密度为ρg·cm-3,则晶体中最近的两个Al原子的距离为___________cm。(阿伏加德罗常数的值用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(F)是重要的医药中间体,其制备流程如图的所示:

已知: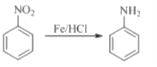
回答下列问题:
(1)B的名称是___________,F中官能团的名称为___________。
(2)写出符合下列条件B的同分异构体的结构简式___________。
a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是_______________。
(4)写出⑥的化学反应方程式_____________________________________。
(5)写出⑧的反应试剂和条件__________________________。
(6)以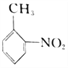 合成
合成 的流程:___________________________________________。
的流程:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如图所示实验。
Ⅰ.实验探究
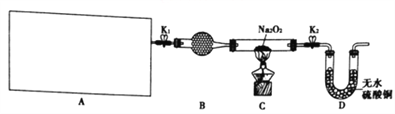
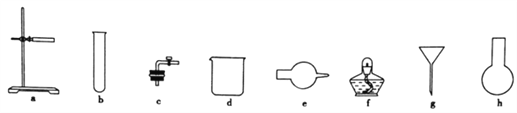
(1)图中A是制取氢气的装置,从图所示的仪器中选择一部分组装成一套能随开随停的装置,选择的仪器编号是_________。
(2)装置A中用粗锌和稀盐酸制取氢气,B装置中所盛放的试剂是_________,其作用是________。
(3)下面是实验过程中的重要操作,正确的顺序是_________(填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间 B.用小试管收集气体并检验其纯度
C.打开K1、K2 通入氢气 D.停止加热,充分冷却,关闭K1、K2
(4)实验过程中观察到淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推出Na2O2与H2反应的化学方程式为___________________________________________________。
Ⅱ.数据处理
(5)实验结束后,该同学欲测定C 装置硬质玻璃管内白色固体中未反应完的Na2O2含量。其操作流程如下:![]()
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和_________,操作2的名称是_________。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_________(填“偏 大” “偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com