
| A. | CO2、H2O都是非极性分子 | |
| B. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| C. | 用价层电子对互斥理论预测H2S和BF3的立体结构,分别为V形、三角锥形 | |
| D. | 石英、食盐、金属钠、干冰的熔点依次降低 |
分析 A.正负电荷重心重合的分子为非极性分子,正负电荷重心不重合的分子为极性分子;
B.氢键属于分子间作用力;
C.H2S和BF3中心原子价层电子对个数分别是4、3,且硫化氢分子中S原子含有两个孤电子对、三氟化硼中B原子没有孤电子对,根据价层电子对互斥理论确定两种微粒空间构型;
D.一般来说,晶体熔沸点:原子晶体>离子晶体>分子晶体,金属晶体熔沸点差别较大.
解答 解:A.正负电荷重心重合的分子为非极性分子,正负电荷重心不重合的分子为极性分子,CO2是直线形非极性分子,H2O是V形极性分子,故A错误;
B.氢键属于分子间作用力,氢键不属于化学键,故B错误;
C.H2S和BF3中心原子价层电子对个数分别是4、3,且硫化氢分子中S原子含有两个孤电子对、三氟化硼中B原子没有孤电子对,根据价层电子对互斥理论知,前者是V形分子、后者是平面三角形分子,故C错误;
D.一般来说,晶体熔沸点:原子晶体>离子晶体>分子晶体,金属晶体熔沸点差别较大,石英属于原子晶体、氯化钠属于离子晶体、钠属于金属晶体、干冰属于分子晶体,石英、食盐、金属钠、干冰的熔点依次降低,故D正确;
故选D.
点评 本题考查较综合,涉及分子极性判断、化学键、分子空间构型判断、晶体熔沸点大小比较等知识点,侧重考查学生分析判断能力,把握基本概念、物质构成微粒是解本题关键,易错选项是B.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
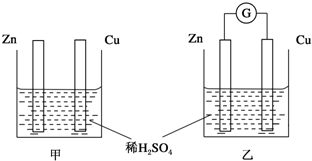
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
| 实验序号 | 金属质量/g | 金属状态 | C(H2SO4)/mol.-L | V(H2SO4)/mL | 溶液温度 | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.1 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.1 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.1 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.1 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.1 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.1 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.1 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com