
【题目】为了探究NO2与过氧化钠反应的情况,甲、乙两位同学设计了如下实验,其装置如图。

已知:2NO2+2NaOH==NaNO3+NaNO2+H2O
试回答下列问题:
(1)仪器A的名称是________________,仪器B的作用是________________________。
(2)装入药品前必须检查装置的气密性,具体操作方法是________________________。
(3)试管中生成NO2反应的离子方程式是________________________________________。
(4)实验过程中,两位同学通过检验得知气体产物中含有较多氧气。该同学通过查阅资料了解NO2具有氧化性,据此甲同学判断NO2与过氧化钠反应可得到氧气,而乙同学认为该结论不合理,理由是__________。为验证自己的想法,乙同学对上述装置进行了改进,具体做法是________________。
(5)改进装置后,再进行实验,两位同学发现过氧化钠的颜色由淡黄色逐渐变成白色,且检验不出氧气的生成,该反应的化学方程式为________________。
【答案】分液漏斗 防止倒吸 关闭分液漏斗活塞,将干燥管末端置于水槽中,微热试管,干燥管末端有气泡产生,停止加热后干燥管中形成一段水柱,则说明装置气密性良好 Cu+4H++2NO3-=Cu2++2NO2↑2H2O 得到的NO2中混有水蒸气,与过氧化钠反应得到氧气 装置I、Ⅱ之间添加一个装有P2O5的干燥管,以除去气体产物中的水蒸气 2NO2+Na2O2=2NaNO3
【解析】
(1)由图知仪器A的名称是分液漏斗;仪器B的作用是防止倒吸。答案:分液漏斗;防止倒吸。
(2)检查装置的气密性的方法是:关闭分液漏斗活塞,将干燥管末端置于水槽中,微热试管,干燥管末端有气泡产生,停止加热后干燥管中形成一段水柱,则说明装置气密性良好。答案:关闭分液漏斗活塞,将干燥管末端置于水槽中,微热试管,干燥管末端有气泡产生,停止加热后干燥管中形成一段水柱,则说明装置气密性良好。
(3)试管中浓硝酸和铜反应生成NO2、硝酸铜和水。所以反应的离子方程式是:Cu+4H++2NO3-=Cu2++2NO2↑2H2O。答案:Cu+4H++2NO3-=Cu2++2NO2↑2H2O。
(4)由装置图分析浓硝酸和铜反应生成NO2、硝酸铜和水,所以得到的NO2中混有水蒸气,水也能与过氧化钠反应得到氧气。改进方法是在装置I、Ⅱ之间添加一个装有P2O5的干燥管,以除去气体产物中的水蒸气。答案:装置I、Ⅱ之间添加一个装有P2O5的干燥管,以除去气体产物中的水蒸气 。
(5)改进装置后,再进行实验,两位同学发现过氧化钠的颜色由淡黄色逐渐变成白色,且检验不出氧气的生成,说明该反应没有氧气生成,反应的化学方程式为2NO2+Na2O2=2NaNO3。答案:2NO2+Na2O2=2NaNO3。


科目:高中化学 来源: 题型:
【题目】根据所学物质结构知识,回答下列问题
(1) LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子的外围电子排布式为______________________。第四电离能:Ⅰ4(Co)___________I4(Fe)(填“>”或“<”)。PO43-的空间构型为______________________。
(2)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图所示,则B原子的杂化方式为______________________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,氨硼烷(NH3BH3)的结构式为______________________(标出配位键),写出一种与氨硼烷互为等电子体的分子的化学式:______________________。
(3)常温常压下,硼酸(H3BO3)晶体结构为层状,其二维平面结构如图所示,1mol H3BO3晶体中含有氢键的数目为___________(用NA表示阿伏加德罗常数的值);请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:______________________。

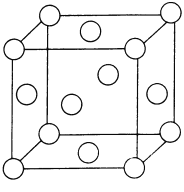
(4)干冰晶体以及Cu晶体的结构都如图表示(○表示一个CO2分子或一个Cu原子),晶体中正八面体和正四面体空隙数的比值为___________。铜的硫化物有三种晶体,其中一种是Cu2+为面心立方最密堆积,而晶体中全部正四面体空隙的二分之一被S2-占据,如果两个最近的离子核间距为acm,NA表示阿伏加德罗常数的值,则该晶体的密度为___________g/cm3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=_____________,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正)___v(逆) (填“>” “=” “<”),反应经过2min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____,CO的平衡转化率=____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A、减少Fe的量 B、增加Fe2O3的量 C、移出部分CO2 D、提高反应温度 E、减小容器的容积 F、加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是一种中等活泼金属,化合价为+2价和+3价,其中CoC12易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:
(1)甲同学用Co2O3与盐酸反应制备CoC124H2O,其实验装置如下:

①烧瓶中发生反应的离子方程式为______。
②由烧瓶中的溶液制取干燥的CoC124H2O,还需经过的操作有蒸发浓缩、______、洗涤、干燥等。
(2)乙同学利用甲同学制得的CoC124H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdC12溶液能被CO还原为Pd。

①装置E、F是用于检验CO和CO2的,其中盛放PdC12溶液的是装置______(填“E”或“F”)。
②装置G的作用是______;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是______。
③通氮气的作用是______。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是______。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是

A. 传感器工作时,工作电极电势高
B. 工作时,H+通过交换膜向工作电极附近移动
C. 当导线中通过1.2×l0-6 mol电子,进入传感器的甲醛为3×10-3 mg
D. 工作时,对电极区电解质溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应所得的有机产物只有一种的是
A. 等体积的甲烷与氯气在光照条件下的取代反应
B. 丙烯与氯化氢的加成反应
C.  在NaOH醇溶液作用下的消去反应
在NaOH醇溶液作用下的消去反应
D. 甲苯与液溴在溴化铁做催化剂条件下的取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )

A. 0.5% B. 1.0% C. 0.1% D. 1.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃(聚甲基丙烯酸甲酯)具有透光率高、自重轻、安全性能高等优点,目前它广泛用于制作仪器仪表零件、照明灯罩、光学镜片、透明屋顶、电话亭、广告灯箱、标志牌等。
下图是以2—甲基丙烯为原料合成有机玻璃E(聚—2—甲基丙烯酸甲酯)的路线:
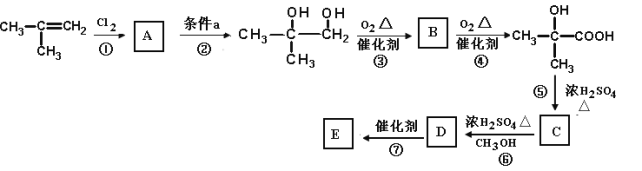
(1)有机化合物 中含有的官能团名称是_____________________________________。
中含有的官能团名称是_____________________________________。
(2)写出B的结构简式:___________________________________
(3)写出反应①的化学方程式____________________________________________________________________
(4)写出反应⑥的化学方程式__________________________________________________________________
(5)在上述① ~ ⑥反应中,属于取代反应的是______________,属于加成反应的是___________,
(6)写出E的结构简式:___________________________
(7)写出有机物 通过缩聚形成高分子聚酯F的结构简式:___________________________
通过缩聚形成高分子聚酯F的结构简式:___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com