
| A.①②③④⑤ | B.①②③④ |
| C.①②③⑤ | D.①②④⑤ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.Fe、Cu、Zn、Al | B.Cu、Fe、Al、Zn |
| C.Al、Zn、Fe、Cu | D.Cu、Fe、Zn、Al |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
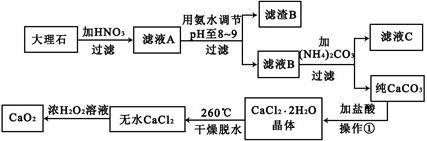
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| | Fe3+ | Fe2+ | Zn2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32- 2I-+S4O62-
2I-+S4O62-查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.海水资源的利用包括海水水资源利用和化学资源利用 |
| B.海水既苦又涩,不能直接利用 |
| C.海水中某些金属元素总储量很大,但富集程度却很低 |
| D.海水淡化应同化工生产结合,同能源技术结合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
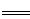
科目:高中化学 来源:不详 题型:填空题
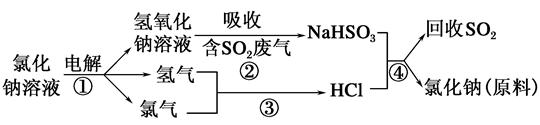
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属被人类开发利用的大致年限之所以有先后,主要取决于金属在地壳中的含量多少 |
| B.海水中含有丰富的碘元素,因此碘被称为“海洋元素” |
| C.高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 |
| D.在海水中加入石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
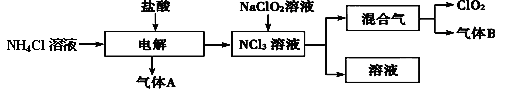
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com