
实验室用二氧化锰和浓盐酸反应制取氯气。
(1)若用200mL 10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为 0.50mol(填“大于”、“等于”或“小于”),原因是 。
(2)8.7g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?产生的氯气在标准状况下的体积是多少?
(8分)(1)小于 加热过程浓盐酸中HCl挥发掉部分;随着反应进行,浓盐酸变稀,稀盐酸不与二氧化锰反应。(2)被氧化的氯化氢的物质的量为0.2 mol,产生的氯气在标准状况下的体积是2.24L
解析试题分析:(1)盐酸的物质的量是0.2L×10mol/L=2mol,由于过程浓盐酸中HCl挥发掉部分;随着反应进行,浓盐酸变稀,稀盐酸不与二氧化锰反应,所以根据方程式MnO2 + 4H+ + 2Cl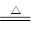 Mn2+ + 2H2O + Cl2↑可知,产生氯气的物质的量为小于0.50mol。
Mn2+ + 2H2O + Cl2↑可知,产生氯气的物质的量为小于0.50mol。
(2)8.7g二氧化锰的物质的量是8.7g÷87g/mol=0.1mol,则根据方程式可知
MnO2 + 4HCl(浓)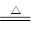 MnCl2+ 2H2O + Cl2↑
MnCl2+ 2H2O + Cl2↑
1mol 4mol 22.4L
0.1mol 0.4mol 2.24L
所以被氧化的氯化氢的物质的量是0.4mol÷2=0.2mol
产生的氯气在标准状况下的体积是2.24L
考点:考查浓盐酸和二氧化锰反应的有关计算
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑思维能力和发散思维能力。该的关键是明确稀盐酸不能被二氧化锰氧化,然后具体问题、具体分析即可。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、实验室用二氧化锰和浓盐酸制取氯气:MnO2+4HCl
| ||||
B、铜与稀硝酸反应:Cu+4H++2N
| ||||
C、向氯化铝溶液中通入过量氨气:A13++4OH-?A1
| ||||
D、向Ca(OH)2溶液中加入过量NaHCO3溶液:Ca2++2HC
|
查看答案和解析>>
科目:高中化学 来源: 题型:
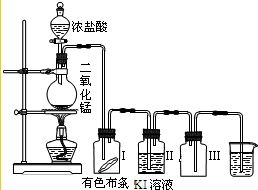 某同学实验室用下列装置探究氯气的性质.
某同学实验室用下列装置探究氯气的性质.查看答案和解析>>
科目:高中化学 来源: 题型:
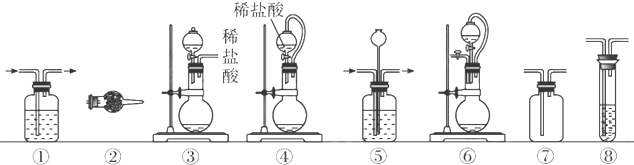
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com