
| A. | 常温下,pH=4.3 的 CH3COOH与 CH3COONa 混合溶液中 tc(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4,溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCL)>KspCAg2CrCO4),则 AgCl的溶解度大于Ag2CrCO4 | |
| D. | 向冰醣酸加少就水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$增大 |
分析 A.常温下,CH3COONa与CH3COOH的混合溶液,pH=4.3,则c(OH?)<c(H+),根据电荷守恒判断;
B.NaCl属于强酸强碱盐,CH3COONH4属于弱酸弱碱盐,水解促进水的电离;
C.氯化银和铬酸银的化学式类型不同,不能直接根据溶度积比较溶解度大小;
D.醋酸被稀释后,溶液中醋酸的物质的量减小、氢离子的物质的量增大.
解答 解;A.pH=4.3,则c(OH?)<c(H+),根据电荷守恒得c(CH3COO?)>c(Na+),故A正确;
B.NaCl属于强酸强碱盐,对水的电离无影响,CH3COONH4属于弱酸弱碱盐,能够水解促进水的电离,故NaCl溶液和CH3COONH4溶液中,水的电离程度前者小于后者,故B错误;
C.AgCl、Ag2CrO4的化学式类型不同,不能直接利用溶度积判断溶解度大小,故C错误;
D.醋酸中加入少量水后,醋酸的电离程度增大,则溶液中醋酸的物质的量减小,氢离子的物质的量增大,由于在同一溶液中,则$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$减小,故D错误.
故选:A.
点评 本题考查了离子浓度大小比较、弱电解质的电离平衡及其影响,题目难度中等,明确电离平衡及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
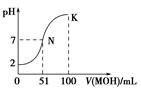 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )| A. | HA为一元强酸 | |
| B. | MOH为一元弱碱 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若四种元素均为主族元素,则d元素的原子半径最大 | |
| B. | 若b最外层电子占据三条轨道,则a的单质可用于冶炼金属 | |
| C. | 若a为非金属元素,则c的气态氢化物的水溶液可能呈碱性 | |
| D. | 若a最外层有两个未成对电子,则d的单质常温下不可能为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{KMnO_{4}(H+)}{→}$
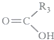
$\stackrel{KMnO_{4}(H+)}{→}$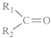 +
+
 .
.
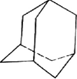 )是月桂烯的一种同分异构体,其一氯代物有2种.
)是月桂烯的一种同分异构体,其一氯代物有2种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{46}$Ti比${\;}_{22}^{47}$Ti少1个质子 | |
| B. | ${\;}_{22}^{46}$Ti和${\;}_{22}^{47}$Ti的化学性质相同 | |
| C. | ${\;}_{22}^{46}$Ti的相对原子质量是46 | |
| D. | ${\;}_{22}^{47}$Ti的原子序数为47 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)═2SO3(l)+Q,Q>196.64kJ | |
| B. | 2mol SO2气体和过量的O2充分反应放出196.64kJ热量 | |
| C. | 1 L SO2(g)完全反应生成1L SO3(g),放出98.32 kJ热量 | |
| D. | 使用催化剂,可以减少反应放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2molNa202和Na2S的混合物中共含有离子数目为0.6NA | |
| B. | 2.24LNz和足量Hz充分反应转移的电子数目为0.6NA | |
| C. | 含氢原子1.806×l024的甲基中含有的质子数为10NA | |
| D. | 1.0L1.0mol/LFeCI3溶液全部转化成氢氧化铁胶体所得胶粒数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中加入少量KCl固体后的碱性溶液一定有:c(Na+)-c(CH3COO-)=c(OH-)-c(H+) | |
| B. | 同浓度的CH3COONa和NaClO混合液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下,在10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL(忽略溶液体积变化) | |
| D. | 某温度下,pH=11的NH3•H2O和pH=1的盐酸等体积混合后恰好完全反应,反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为0.05 mol•L-1(忽略溶液体积变化) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com