
【题目】下列各组混合物,可以用分液漏斗分离的是
A. 苯和水 B. 苯和溴苯 C. 乙醇和溴水 D. 乙酸和乙醇
科目:高中化学 来源: 题型:
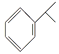
【题目】异丙烯苯和异丙苯是重要的化工原料,二者存在如下转化关系: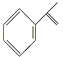 +H2
+H2![]()
 下列说法中正确的是( )
下列说法中正确的是( )
A. 异丙烯苯与苯互为同系物
B. 异丙烯苯不能发生取代反应
C. 异丙苯的一溴代物有5种
D. 0.5 mol异丙苯完全燃烧消耗氧气5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S转化是环保和资源利用的研究课题。將烧碱吸收H2S后的溶液加人如图装置,可以回收单质硫,甲为二甲醚(CH3OCH3)一空气燃料电池。
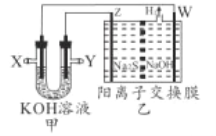
下列推断正确的是
A. Y极充入二甲醚 B. 电子由X![]() W
W![]() 溶液
溶液![]() Z
Z![]() Y
Y
C. Z极反应式为S2--2e-=S D. 电解后,乙装置右池中c(NaOH)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬合金具有高硬度、耐腐蚀特性,广泛应用于精密仪器制造,由高碳铬铁合金废料制取铬的简单流程如下:
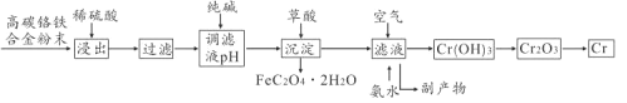
已知:Cr+H2SO4=CrSO4+H2↑
请回答下列问题:
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有_____ (写一条即可)
(已知: ![]() )
)
(2)用纯碱调节溶液酸度,若纯碱过量,则可能导致的后果是______,副产物中两种主要物质的化学式为_____________
(3)加入草酸发生反应的离子方程式为______;利用铝热反应冶炼铬。请写出该反应的化学方程式_________
(4)向滤液中通入空气,加入氨水后发生反应的化学方程式为_________
(5)利用如图装置,探究铬和铁的活泼性强弱。
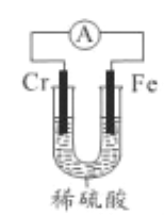
能证明铁比铬话泼的实验现象是______,工业上,在钢器具表面镀铬,用硫酸铬(CrSO4)溶液作电解液,阴极的电极反应式为___________。
(6)已知高碳铬铁度料中铁铭元素质量比为14:13.上述流程中铁元素转化草酸亚铁的利用率为80%。废料中提取金属铬的总转化率为95%,如果得到草酸亚铁品体(FeC2O4·2H2O)质量为18.00吨,则可以冶炼铬的质量为____吨(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些垃圾可以用卫生填埋、焚烧、堆肥等方法处理。下列垃圾中,不适合用这样的方法处理的是( )
A.农作物垃圾,如秸秆等B.电池C.纸品D.纯棉纺织品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx可以消除氮氧化物的污染。
已知CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1。若在标准状况下4.48 L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
A. 173.4 kJ B. 232 kJ C. 368.8 kJ D. 114.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物、化学研究等方面具有广泛用途。
(1)为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL0.5mol·L-1 KI溶液,向其中加入0.1 mol·L-1FeCl3溶液1 mL,充分反应。下列实验操作能验证该反应是否存在限度的是___。
A.再滴加AgNO3溶液,观察是否有黄色沉淀产生
B.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成血红色
(2)已知1molH2(g)、1molI2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436kJ、151kJ、 300kJ的能量,则氢气和碘蒸气反应生成HI气体的热化学方程式为_____。
(3)Bodensteins研究了下列反应:2HI(g)![]() H2(g) +I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
H2(g) +I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 |
n(HI) | 1 | 0.91 | n |
0min到20min HI的平均反应速率为_______;
反应到达40min时,剩余HI 的物质的量____0.82mol(填“﹥” “﹤”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
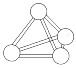
A. N4分子中只含有非极性键B. N4分子属于一种新型的化合物
C. 1 mol N4分子所含共价键数为4NAD. N4沸点比P4(白磷)高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com