
| A. | 1H与2H | B. | O2与O3 | C. | 乙烷与甲烷 | D. | 正丁烷与异丁烷 |
科目:高中化学 来源: 题型:实验题
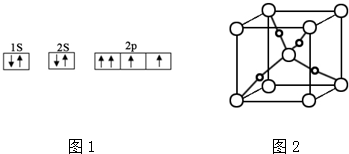
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 0.1mol•L-1的KHA溶液,其PH=10:c(K+)>c(OH-)>c(HA-)>c(H+) | |
| C. | 20mL0.1mol•L-1醋酸钠溶液与10mL 0.1mol•L-1盐酸混合后的溶液中: 2 c(H+)+c(CH3COOH)=c(CH3COO-)+2 c(OH-) | |
| D. | 在25mL 0.1 mol•L-1NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液,溶液pH变化如图所示,在A、B间任一点,溶液中一定都存在下列关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)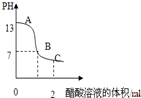 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | HCOOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH═CH2与HBr | B. | 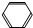 -CH3与混酸(浓HNO3和浓H2SO4,30℃) -CH3与混酸(浓HNO3和浓H2SO4,30℃) | ||
| C. | CH3CH═CHCH3与HBr | D. | 光照条件下CH3CH3与Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰用于人工降雨 | |
| B. | 蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀 | |
| C. | 溶洞中钟乳石的形成 | |
| D. | 豆科作物的根瘤菌对空气中氮的固定 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
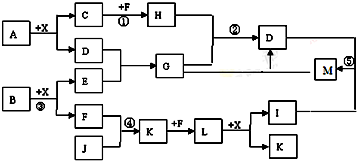
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
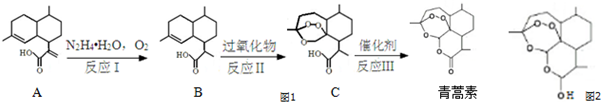
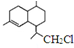 为原料合成B,写出其合成路线(指明所用试剂和反应条件).
为原料合成B,写出其合成路线(指明所用试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
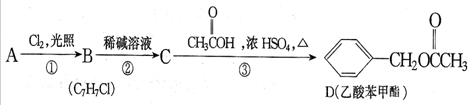
 .
.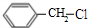 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$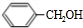 +NaCl.
+NaCl.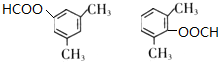 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com