
分析 CO(NH2)2分子含有1个C原子、2个N原子、4个H原子、1个O原子,故含有碳原子、氧原子的物质的量等于CO(NH2)2的物质的量,N原子物质的量为CO(NH2)2的2倍,H原子物质的量为CO(NH2)2的4倍,由此分析解答.
解答 解:CO(NH2)2分子含有1个C原子、2个N原子、4个H原子、1个O原子,则:n(C)=n[CO(NH2)2]=1mol,n(N)=2n[CO(NH2)2]=2mol,n(H)=4n[CO(NH2)2]=4mol,n(O)=n[CO(NH2)2]=1mol,水分子含有1个氧原子,二者含有氧原子数目相等,则二者物质的量相等,水的物质的量为1mol,故答案为:1;2;4;1.
点评 本题考查物质的量有关计算,比较基础,注意对化学式意义的理解.


科目:高中化学 来源: 题型:选择题
| A. | KOH 溶液与FeCl3 溶液加足量稀硝酸 | |
| B. | Ba(OH)2 溶液与KNO3溶液加足量H2SO4 | |
| C. | CuSO4溶液与NaOH 溶液加足量稀盐酸 | |
| D. | BaCl2 溶液与Na2CO3 溶液加足量稀醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 参数 | 比较 | 解释 |
| A | 还原性 | Br->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| B | 半径 | Na+<Mg2+<Al3+ | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③① | C. | ②①③ | D. | ①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质(杂质) | 试剂 | 有关化学方程式 |
| NaHCO3(Na2CO3) | CO2 | Na2CO3+H2O+CO2=2NaHCO3 |
| FeCl2(FeCl3) | Fe | 2FeCl3+Fe═3FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.005mol | B. | 0.01mol | C. | 0.025mol | D. | 0.03mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
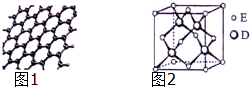 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com