
某有机物的结构简式为: ,则此有机物可发生的反应类型有:
,则此有机物可发生的反应类型有:
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦缩聚 ⑧中和
A.①②③⑤⑥ B. ②③④⑤⑥⑧
C.①②③④⑤⑥⑧ D. ①②③④⑤⑥⑦⑧
科目:高中化学 来源: 题型:
下列有关物质性质及应用的说法正确的是
A.过量的铜与浓硝酸反应可生成NO
B. Fe在O2中的燃烧产物可用于制红色涂料
C. Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到
D.Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是
A.金属钠和水的反应:Na+2H2O=Na++ OH一+H2↑
B.向次氯酸钙溶液中通入SO2:
Ca2++2ClO-+H2O+SO2=CaSO3+2HClO
C.过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O
D.过量的NaHSO4溶液与Ba(OH)2溶液反应:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
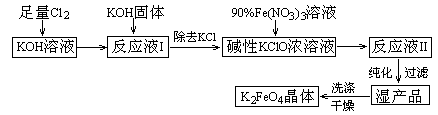 |

已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 →5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 +3KClO+10KOH →2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在温度 (填“较高”或“较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度约为 。
(5)在“反应液I”中加KOH固体的目的是 (选填序号)。
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
查看答案和解析>>
科目:高中化学 来源: 题型:
请写出下列化学反应方程式:
(1)乙烯通入溴水中: ▲
(2)2-氯丙烷与氢氧化钠水溶液共热: ▲
(3)乙醇和乙酸在浓硫酸作用下反应: ▲
(4)苯酚与甲醛在加入浓盐酸作用下发生缩聚反应: ▲
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+
B.用玻璃棒蘸取新制氯水,点在PH试纸的中央,与标准比色卡比较,测定氯水的PH
C.某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+
D.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备H2的一种重要方法是:
 CO(g) + H2O(g)
CO(g) + H2O(g)  CO2 (g) + H2(g) △H=Q kJ/mol
CO2 (g) + H2(g) △H=Q kJ/mol
已知
该反应的平衡常数K与温度T的关系右上图所示。若在一固定的密闭容器中,
850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化
关系如下表:

已知:850℃ 时该反应的化学平衡常数K = 1.0 ,请回答下列问题:
(1) Q 0(填“ > ”、“ = ”或“<” )。
若在850℃时向反应容器中充人H2O(g),K 值 (填增大、减小、不变)
(3)上表中 c2为 mol/L , CO(g)的转化率为 (保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com