
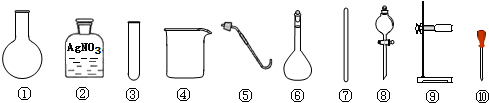
| A. | 除去粗盐中的不溶性杂质,选用 ④⑦⑧⑨ | |
| B. | 检验A的滤液中是否含SO42-,选用 ②③⑩ | |
| C. | 利用提纯后的NaCl固体配制0.1mol/L的溶液,选用 ④⑥⑦⑩ | |
| D. | 用NaCl固体与浓H2SO4共热制备HCl气体,选用 ①⑤⑧⑨ |
分析 A.除去粗盐中的不溶性杂质用过滤;
B.检验SO42-时要避免 SO32- 的影响;
C.用氯化钠固体配制0.1mol/L的氯化钠溶液的步骤有:溶解、转移、洗涤、定容、摇匀等,根据以上配制步骤用到的仪器进行判断;
D.用NaCl固体与浓H2SO4共热制备HCl气体需要加热.
解答 解:A.除去粗盐中的不溶性杂质用过滤,使用漏斗、烧杯、玻璃棒,不能用分液漏斗,故A错误;
B.亚硫酸银是白色沉淀,不能选用硝酸银,应首先在试液中加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,故B错误;
C.用氯化钠配制0.1mol/L的氯化钠溶液,涉及的步骤有:溶解氯化钠,用到烧杯和玻璃棒;转移溶液,用到玻璃棒和容量瓶;洗涤烧杯和玻璃棒;定容溶液,用到胶头滴管,所以使用的仪器有:烧杯、玻璃棒、容量瓶、胶头滴管,故C正确;
D.用NaCl固体与浓H2SO4共热制备HCl气体需要加热,使用酒精灯、圆底烧瓶、分液漏斗、带双孔塞的导管,用不到⑤,故D错误.
故选C.
点评 本题考查常见仪器的使用和化学基本操作的方法,侧重实验装置、仪器的作用的考查,题目难度不大,注意在学习中加强基础知识的积累.


科目:高中化学 来源: 题型:解答题
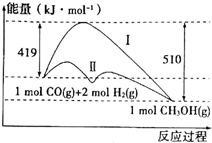 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
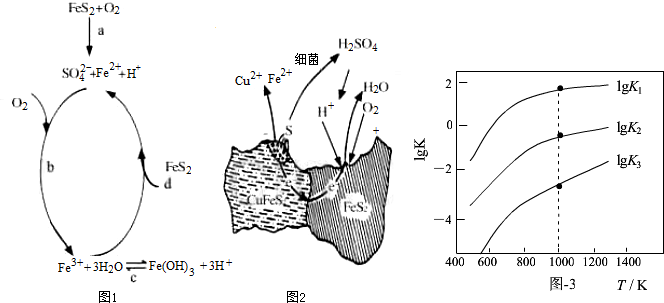
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)下列过程中不一定释放能量的是AB(请填编号)
(1)下列过程中不一定释放能量的是AB(请填编号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
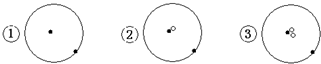
 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )| A. | ①②③是三种化学性质不同的粒子 | B. | ①②③具有相同的质量数 | ||
| C. | ①②③为同素异形体 | D. | ①②③互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾是一种自然现象,对人体健康影响不大 | |
| B. | PM2.5是指大气中直径小于或等于2.5μm的颗粒物 | |
| C. | 大气中SO2含量的增加会导致温室效应加剧 | |
| D. | 酸雨是pH小于7的雨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中仅发生一个反应 | |
| B. | Fe3+能催化H2O2的分解 | |
| C. | 反应过程中溶液pH不断减小 | |
| D. | FeSO4与等物质的量的H2O2恰好反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com