
【题目】如果25℃时,Kw=1.0×10﹣14 , 100℃下Kw=1.0×10﹣12 . 下列说法错误的是( )
A.100℃下水的电离程度较大
B.前者的C(H+)较后者小
C.水的电离过程是一个放热过程
D.温度越高,Kw越大
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】H3PO2(次磷酸)是一种一元弱酸,H3PO2易溶于水且具有较强的还原性。
(1)H3PO2的结构式为。
(2)H3PO2在水溶液中的电离方程式为。
(3)不断将新制的PH3通入搅拌的碘悬浮液中,直至碘的颜色消失,可得到次磷酸和氢碘酸,则该反应中氧化产物与还原产物的物质的量之比为。
(4)酸性条件下,H3PO2可将Cr2O72-还原为Cr3- , 其本身被氧化为磷酸,该反应的离子方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请回答下列问题:
Ⅰ、(1)石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成__________________。
(2)漂白粉的有效成分是________(均填化学式)。硅是无机非金属材料的主角,请你举出一种含硅的材料名称__________________。
(3)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是________________________________。
(4)高分子材料可以分成无机高分子材料和有机高分子材料。[AlFe(OH)n Cl6-n]m属于无机高分子材料,是一种新型高效净水剂,它广泛应用生活用水和工业污水的处理,其中铁元素的化合价为________;
Ⅱ、高纯二氧化硅可用来制造光纤。某稻壳灰的成分为:
组 分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
通过如下流程可由稻壳灰制备较纯净的二氧化硅。
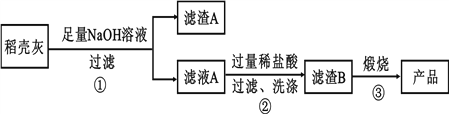
请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中属于两性氧化物的是____________。
(2)步骤①中涉及SiO2的离子反应方程式为________________________________。
(3)滤渣A的成分有______________(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法正确的是
A. 5.6克铁与足量的氯气点燃充分反应,失电子数为0.2 NA
B. 2.3克金属钠常温下在空气中充分反应和在空气中点燃失电子数之比为1:2
C. 7.8克过氧化钠与足量水反应转移电子数为0.2NA
D. 标况下22.4L纯净的NO2溶于水转移电子数为2/3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁红涂料中添加有CuO或FeO中的一种,为探究添加物的成分设计如下实验方案。
(1)请写出实验步骤、预期现象,对应的离子方程式。
(限选试剂:铁粉、3mol/LH2SO4、0.1mol/L酸性KMnO4溶液、10%H2O2、KSCN溶液)
① , ② , , ③ ,
④操作步骤③中反应的离子方程式为。
(2)经分析该铁红涂料中有FeO,为测定铁红中铁的质量分数,兴趣小组的同学称量11.6g该铁红涂料进行了如下实验。
已知:气体由草酸晶体受热分解得到:H2C2O4·2H2O ![]() CO2↑+CO↑+3H2O。且除铁红外所用试剂均过量。
CO2↑+CO↑+3H2O。且除铁红外所用试剂均过量。
①装置A、B中的试剂依次是、。
②气体通入后,接下来的操作是 , 然后对C装置加热。
③实验前后称得D装置增重8.8g,则此铁红中铁的质量分数是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:
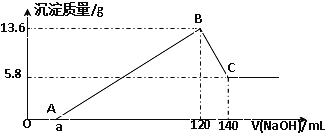
(1)写出OA段和BC段反应的离子方程式:
OA:________________________________ ; BC:_____________________________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
(5)a的值是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有H+、K+、Mg2+、Al3+、Fe3+、Cl-、SO![]() 、CO
、CO![]()
(1)取该溶液20 mL,加入NaOH溶液,只产生白色沉淀,且产生的沉淀量与加入1.0 mol·L-1NaOH溶液的体积之间的关系如图所示;水样中一定含有的阳离子是___________,其物质的量之比是_________,并可排除______的存在。
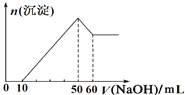
(2)另取该溶液20 mL,加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。试根据上述实验推测Cl-是否存在?___ (填“是”或“否”)。
(3)无法确定的离子是______,可通过____________方法确定其是否存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关自然资源的开发利用的说法不正确的是( )
A. 证明海带中存在碘元素的实验中,需将干海带洗净后置于坩埚中灼烧
B. 以Cu2S为原料可采用火法炼铜冶炼出金属Cu
C. 海水晒盐后的母液中,直接加入CCl4可萃取Br2单质
D. 资料表明,蓝铜矿的主要成分为2CuCO3·Cu(OH)2,当它与焦炭一起高温加热时,可以生成铜、二氧化碳和水。该反应的化学方程式为:2[2CuCO3·Cu(OH)2]+3C![]() 6Cu+7CO2↑+2H2O
6Cu+7CO2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com