
| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |
分析 原子核外电子排布应符合构造原理、能量最低原理、洪特规则和泡利不相容原理,一般来说离子的核外最外层达到8电子稳定结构,根据构造原理,s能级最多可容纳2个电子,p能级有3个轨道最多可容纳6个电子,电子总是优先从能量低的能层、能级排列,其中s2是原子得两个电子形成的稳定的结构,所以第三能层中的电子排布最多应为3s23p6,据此分析解答.
解答 解:A.Si原子核外有14个电子,核外电子排布式为:1s22s22p63s23p2,故A错误;
B.O原子核外有8个电子,O2-核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故B正确;
C.Na的原子序数为11,离子的核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故C正确;
D.Al原子核外有13个电子,Al原子核外电子排布式为1s22s22p63s23p1,故D正确;
故选A.
点评 本题考查了原子或离子核外电子排布,明确排布规律及其规则是解本题关键,为考试热点,知道每个能级最多排列的电子数,要遵循构造原理,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 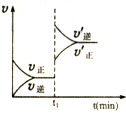 表示某吸热反应t1时刻升高温度时,正逆反应速率的变: | |
| B. | 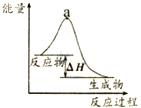 表示某放热反应过程的能量变化,若使用催化剂,a点会降低 | |
| C. | 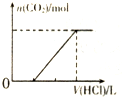 表示向含等物质的量的NaOH、Na2CO3混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 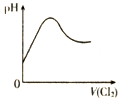 表示Cl2通入H2SO3溶液中pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、CO32-、Cl- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | K+、H+、SO42-、OH- | D. | Ag+、Al3+、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铀原子的中子数为238 | |
| B. | 铀原子的中子数与质子数之差为142 | |
| C. | 铀原子的电子数为92 | |
| D. | 92235U与92238U互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
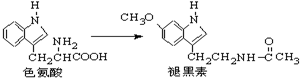
| A. | 色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点 | |
| B. | 褪黑素与色氨酸结构相似,也具有两性化合物的特性 | |
| C. | 在一定条件下,色氨酸可发生缩聚反应 | |
| D. | 在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com