
| A. | 1mol氯气参加氧化还原反应,转移的电子数一定为2 NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,44g二氧化碳分子中所形成的共用电子对数为4NA | |
| D. | 常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA |
分析 A、氯气参与反应时可能只做氧化剂被还原,也可能既做氧化剂又做还原剂,发生歧化反应;
B、等物质的量铁和氯气反应生成氯化铁,铁过量,反应的电子转移根据氯气计算;
C、质量换算物质的量结合二氧化碳分子结构计算共用电子数;
D、根据氧气和臭氧混合气体中含有的氧原子质量计算出氧原子的物质的量及含有的质子数目;
解答 解:A、氯气参与反应时可能只做氧化剂被还原,此时1mol氯气转移2mol电子;但氯气也可能既做氧化剂又做还原剂,发生歧化反应,如在与NaOH溶液的反应中:Cl2+2NaOH=NaCl+NaClO+H2O,1mol氯气参与反应时转移1mol电子,故A错误;
B、等物质的量铁和氯气反应生成氯化铁,铁过量,反应的电子转移根据氯气计算,转移电子数0.2NA,故B错误;
C、44g二氧化碳分子物质的量为1mol,二氧化碳结构为O=C=O,分子中所形成的共用电子对数为4NA,故C正确;
D、1.6g氧气和臭氧的混合气体中含有1.6g氧原子,含有0.1mol氧原子,含有的质子的物质的量为0.8mol,混合气体中含有质子总数为0.8NA,故D正确;
故选AB.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
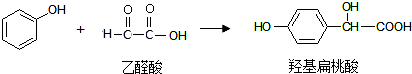
| A. | 羟基扁桃酸可以发生加成反应 | |
| B. | 上述反应属于取代反应 | |
| C. | 乙醛酸的核磁共振氢谱中有2个吸收峰 | |
| D. | 羟基扁桃酸能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它有酸性,能与纯碱溶液反应 | |
| B. | 它可以水解,水解产物只有一种 | |
| C. | 1 mol该有机物最多能和7 mol NaOH反应 | |
| D. | 该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:| 实验编号 | 待测液体积/mL | 所消耗氢氧化钠标准液的体积/mL |
| 1 | 25.00 | 26.30 |
| 2 | 25.00 | 26.34 |
| 3 | 25.00 | 19.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com