
科目:高中化学 来源: 题型:
为探究苯与溴的取代反应,甲用右图装置I进行如下实验:
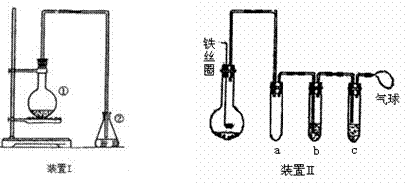 |
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3-5分钟后发现滴有AgNO3的锥形瓶中有浅黄色沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为_________________________________。
(2)①中长导管的作用是____________________________________。
(3)要想得到纯净的产物,可用稀NaOH溶液,蒸馏水洗涤。洗涤分离粗产品应使用的最主要仪器是____________。检验产物已纯净的方法是 ____________________。
(4)乙同学设计右图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯、液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是_____________________________。 能证明苯和液溴发生的是取代反应,而不是加成反应,那试管b中应加入 ,试管c中应加入 。
(5)比较两套装置,装置Ⅱ的两个优点是①___________________②____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,
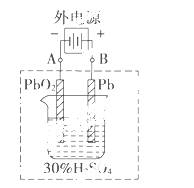
请回答下列问题(不考虑氢、氧的氧化还原):
(1)电解液中H2SO4的浓度将变______________________;
当外电路通过1 mol电子时,理论上负极板的质量增加__________g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成________,B电极上生成____________,此时铅蓄电池的正负极的极性将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
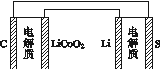
已知:
锂离子电池的总反应为
LixC+Li1-xCoO2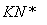 C+LiCoO2
C+LiCoO2
锂硫电池的总反应2Li+S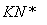 Li2S
Li2S
有关上述两种电池说法正确的是( )
A.锂离子电池放电时, Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.下图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
A.脱氧过程是吸热反应 ,可降低温度,延长糕点保质期
,可降低温度,延长糕点保质期
B.脱氧过程中铁作原电池正极,电极反应为: Fe-3e→Fe3+
Fe-3e→Fe3+
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e→4OH-
D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁—空气燃料电池,镁—海水燃料电池,镁—过氧化氢燃料电池,镁—次氯酸盐燃料电池。如图为镁—次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是 ( )。

A.放电过程中OH-移向正极
B.电池的总反应式为Mg +ClO-+H2O=== Mg(OH)2↓+Cl-
+ClO-+H2O=== Mg(OH)2↓+Cl-
C.镁电池中镁均为负极,发生氧化反应
D.镁—过氧化氢燃料电池,酸性电解质中正极反应为:H2O2+2H++2e-===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
以NaBH4 (B元素的化合价为+3)和H2O2为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为MnO2,工作原理如图所示。下列说法不
正确的是( )
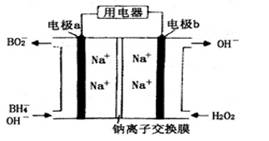
A.该电池工作时Na+由a极区移向b极区
B.电极b是原电池的正极
C.该电池的负极反应为:BH4—+8OH——8 e—= BO2—+6H2O
D.电路中通过6.02×1022个电子时,理论上消耗H2O20.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com