
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
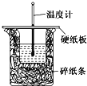
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________,烧杯间填满碎泡沫塑料的作用是________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值__(填“偏大”、“偏小”或“无影响”)。
(3)实验中若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”),理由是_______________________________。
(4)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为2.3 ℃、2.4 ℃、2.9 ℃,则最终代入计算式的温度差的平均值为_____℃。
【答案】环形玻璃搅拌棒保温、隔热,减少实验过程中的热量损失偏小不相等相等60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1烧碱溶液反应,能生成0.027 5 mol H2O,而50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1烧碱溶液反应只能生成0.025 mol H2O,因此所放出的热量不相等;中和热是指在稀溶液中,酸与碱发生中和反应生成1 mol H2O时所放出的热量,与酸、碱的用量无关,因此所求中和热相等2.35
【解析】
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是保温、隔热,减少实验过程中的热量损失;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;
(3)改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1烧碱溶液反应,能生成0.027 5 mol H2O,而50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1烧碱溶液反应只能生成0.025 mol H2O,因此所放出的热量不相等;中和热是指在稀溶液中,酸与碱发生中和反应生成1 mol H2O时所放出的热量,与酸、碱的用量无关,因此所求中和热相等;
(4)根据数据可知,实验③的误差大,舍去,所以温度差的平均值是(2.3℃+2.4℃)÷2=2.35℃。


科目:高中化学 来源: 题型:
【题目】依据题意,完成下列各题:
(1)1.0 g乙醇完全燃烧生成液态水放出1.37 kJ热量,表示乙醇的燃烧热的热化学方程式为__________________________________________________;
(2) “长征”2号火箭的发动机中用“偏二甲肼”(分子式为C2H8N2)和四氧化二氮作为液态燃料。已知a g偏二甲肼与b g四氧化二氮在发动机内燃烧生成稳定的、对环境友好的物质。若生成1 mol N2(g) 的反应热为c kJ,写出热化学方程式______________________________________________;
(3) T ℃时,如图所示, 对应的化学方程式为______________________;
(4) 向足量的H2SO4溶液中加入100 mL 0.4 mol·L-1的Ba(OH)2溶液,放出的热量是5.12 kJ。向足量的Ba(OH)2溶液中加入100 mL 0.4 mol·L-1的HCl溶液,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=______________;
(5) 研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P—P | P—O | O==O | P==O |
键能kJ/mol | 197 | 360 | 499 | x |
已知白磷(P4)的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=_________________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,ΔS<0的是( )
A.氯化钠溶于水中
B.CaCO3(s)分解为CaO(s)和CO2(g)
C.干冰的升华
D.NH3(g)和HCl(g)反应生成NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示回答问题:
(1)化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是______(填字母)。
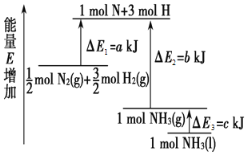
A.N2(g)+3H2(g)===2NH3(l)ΔH=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g)ΔH=2(b-a)kJ·mol-1
C.1/2N2(g)+3/2H2(g)===NH3(l)ΔH=(b+c-a) kJ·mol-1
D.1/2N2(g)+3/2H2(g)===NH3(g)ΔH=(a+b)kJ·mol-1
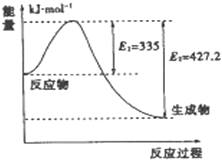
(2)如图是N2和H2反应生成2 mol NH3过程中能量变化的示意图,请计算每生成1 mol NH3放出的热量为__________________________。
(3)2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图所示。
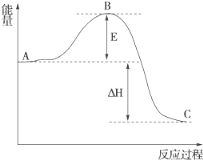
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
①图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?___________________________________。
②图中ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和碳一样也存在一系列氢化物如NH3、N2H4、N3H5、N4H6等。
(1)N3H5的电子式为_______。
(2)已知4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=a kJ/mol K1①;
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=b kJ/mol K2②;
写出N2与O2反应生成1 mol NO气体的热化学方式程式为________________________;
(3)已知NH3·H2O为一元弱碱,N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O+H2O![]() N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
(4)如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
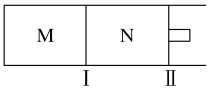
①向M、N中,各通入2 mol N2和6 mol H2。初始M、N容积相同,并保持温度不变。则到达平衡时H2的转化率α(H2)为M________N(填“>”“=”“<”)。
②若在某条件下,反应N2(g)+3H2(g)![]() 2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
I.空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下图所示,试回答下列问题:
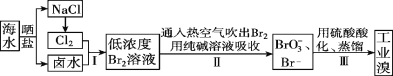
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是________。
(2)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________。
A 氧化性 B 还原性 C 挥发性 D腐蚀性
(3)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:
___Br2+___=___+___Br-+___CO2↑ ________。
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:________。
(5)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:_________。
Ⅱ.目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
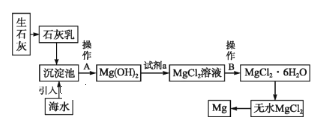
(6)操作A是_________,试剂a是__________。
(7)由无水MgCl2制取Mg的化学方程式是_________。从考虑成本和废物循环利用的角度,副产物可以用于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3kJ。
(2)甲烷与CO2可用于合成水煤气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是________(填字母)。
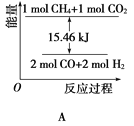



②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。
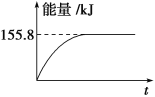
(3)C(s)与H2 (g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=_____。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_______(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成水煤气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com