
【题目】钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1)钼和锆同属过渡金属,锆元素是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷.下列关于锆、二氧化锆的叙述中,正确的是______(填序号)
A 锆合金比纯锆的熔点高,硬度小
B 二氧化锆陶瓷属于新型无机非金属材料
C 将一束光线通过纳米级二氧化锆会产生一条光亮的通路
(2)①途径I碱浸时发生反应的离子方程式为______.
②途径Ⅱ氧化时发生反应的离子方程式为______.
(3)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是______.
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:
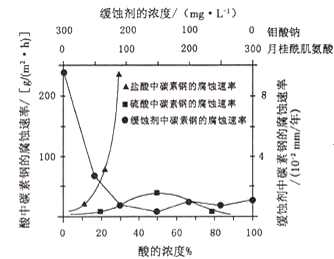
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为______。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是______。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
【答案】B MoO3+CO32-=MoO42-+CO2↑ MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O (NH4)2CO3或(NH4)2SO3 1:1 常温下浓硫酸具有强氧化性,会使铁钝化 nMoS2+xLi++xe-=Lix(MoS2)n ![]()
【解析】
(1)合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质,合金的硬度大,熔点低,陶瓷属于无机非金属材料,二氧化锆为化合物无丁达尔效应;
(2)①途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;
②途径Ⅱ用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,据此可写出离子反应方程式;
(3)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,将NH3和CO2或SO2一起通入水中可生成碳酸盐或亚硫酸盐和水,反应方程式为CO2+2NH3+H2O=(NH4)2CO3或NH3+H2O+CO2=NH4HCO3,前者生成的盐为正盐,后者为酸式盐;
(4)①根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处;
②浓硫酸有强氧化性,能使金属表面形成致密的氧化膜保护层;
(5)根据电池放电时的正极MoS2得电子发生还原反应书写;利用途径I,使所有的Mo转化为钼酸钠晶体,根据得失电子守恒计算。
(1)A.合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的混合物.一般说来合金的硬度一般比各成分金属大,多数合金的熔点低于组成它的成分金属的熔点,所以锆合金比纯锆的熔点低,硬度大,故 A错误;
B.陶瓷属于无机非金属材料,二氧化锆陶瓷属于新型无机非金属材料,故B正确;
C.将一束光线通过胶体会产生一条光亮的通路,但二氧化锆为化合物无丁达尔效应,故C错误;
B正确,故答案为:B;
(2)①途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑,故答案为:MoO3+CO32-=MoO42-+CO2↑;
②途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(3)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3,故答案为:(NH4)2CO3或(NH4)2SO3;
(4)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
(5)放电时,正极应是发生还原反应的,从总反应式中找到发生还原反应的物质为MoS2,而被还原的产物为Lix(MoS2)n,则电极反应式为:nMoS2+xLi++xe-=Lix(MoS2)n,a克的Na2MoO42H2O(分子量为M)中Mo的物质的量为![]() mol,途径I用Lix(MoS2)n,被空气氧化成MoO3,根据电子得失守恒有关系式
mol,途径I用Lix(MoS2)n,被空气氧化成MoO3,根据电子得失守恒有关系式![]() O2~nMoO3,所以需要需要空气(含O2为20%)在标况下的体积为
O2~nMoO3,所以需要需要空气(含O2为20%)在标况下的体积为![]() =
=![]() L,故答案为:nMoS2+xLi++xe-=Lix(MoS2)n;
L,故答案为:nMoS2+xLi++xe-=Lix(MoS2)n;![]() 。
。


科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”,用于药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)
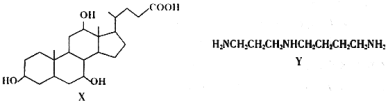
下列叙述错误的是( )
A.X的分子式为![]()
B.1mol X在浓硫酸作用下发生消去反应,最多生成3 mol ![]()
C.X与HBr的反应为消去反应
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+CuB.3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C.AgNO3+NaCl=AgCl↓+NaNO3D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a. 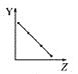 b.
b. 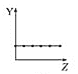 c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度T℃时,在3个体积相同的恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH=-41kJ·mol-1,其起始时投料、各物质的量及其达平衡过程体系热量的变化如表所示:
CO2(g)+H2(g)ΔH=-41kJ·mol-1,其起始时投料、各物质的量及其达平衡过程体系热量的变化如表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系热量的变化(均为正值) | |||
CO | H2O(g) | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 32.8kJ |
② | 8 | 2 | 0 | 0 | Q1 |
③ | 0 | 0 | 1 | 4 | Q2 |
下列说法中不正确的是
A.容器②中热量变化:Q1=65.6kJ
B.平衡后容器①②中各组分体积分数相同
C.三个容器达平衡时,①中的CO、②中的H2O(g)、③中的CO2的转化率相等
D.保持相同条件,向平衡后的容器①中再加入0.1molCO和0.4molCO2(g),平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下,下列说法错误的是( )

已知:滤渣2主要成分是氢氧化铁、氢氧化镁,B的焰色呈黄色。
A.试剂A可以是稀硫酸或盐酸B.加入试剂B除去![]() 、
、![]()
C.滤渣1的主要成分是![]() D.电解氯化铝也可以制取铝
D.电解氯化铝也可以制取铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
D.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:
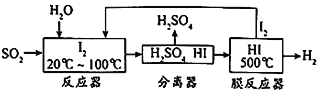
下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com