
| A. | m=$\frac{36.5V}{22.4}$ | B. | ω=$\frac{36.5c}{1000ρ}$ | ||
| C. | c=$\frac{1000ρV}{36.5V+22400}$ | D. | c=$\frac{V}{22.4+22.4V}$ |
分析 标况下VL氯化氢的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,该氯化氢的质量为:36.5g/mol×$\frac{V}{22.4}$mol=$\frac{36.5V}{22.4}$g;1L水的质量约为1000g,则溶液的质量为:1000g+$\frac{36.5V}{22.4}$g,根据V=$\frac{m}{ρ}$可计算出溶液体积,然后根据c=$\frac{n}{V}$可计算出该溶液的物质的量浓度;根据m=ρV、c=cV计算出溶液质量、氯化氢的质量,再根据ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$计算出溶质的质量分数,据此进行解答.
解答 解:A.标况下VL氯化氢的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,该氯化氢的质量为:36.5g/mol×$\frac{V}{22.4}$mol=$\frac{36.5V}{22.4}$g,故A正确;
B.1L该溶液的质量为1000ρg,1L cmol/L的溶液中氯化氢的物质的量为cmol,质量为36.5cg,则该溶液中溶质的质量分数为:$\frac{36.5c}{1000ρ}$,故B正确;
C.1L水的质量约为1000g,则溶液的质量为:1000g+$\frac{36.5V}{22.4}$g,该溶液的体积为:$\frac{\frac{36.5V}{22.4}g+1000g}{1000ρg/L}$=$\frac{36.5V+22400}{22400ρ}$L,则该溶液的物质的量浓度为:$\frac{\frac{V}{22.4}mol}{\frac{36.5V+22400}{22400ρ}L}$=$\frac{1000ρV}{36.5V+22400}$mol/L,故C正确;
D.根据C的计算可知,该溶液的浓度为=$\frac{1000ρV}{36.5V+22400}$mol/L,故D错误;
故选D.
点评 本题考查了物质的量浓度、溶质质量分数的计算,题目难度中等,注意掌握物质的量浓度、溶质质量分数的概念及表达式,正确计算溶液体积为解答关键.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
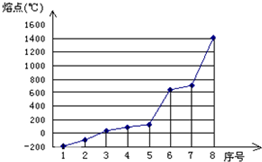 人们生产、生活和科研中离不开材料,下面是与材料有关的题目,请解答:
人们生产、生活和科研中离不开材料,下面是与材料有关的题目,请解答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol石墨和1mol金刚石的总能量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②⑤ | C. | ②⑤ | D. | ③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁粉在0.1 mol氯气中充分燃烧,失去的电子数为0.3NA | |
| B. | 标准状况下,2.24 L CHCl3的分子数为0.1NA | |
| C. | 1L0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).
已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeBr2溶液中通入少量Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com