
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
【答案】 0.075mol/(L·min) 0.175mol/L n=4 1.05
【解析】根据提给信息:v(Z)=0.05mol/(L·min),c(Z)= 0.05×2=0.1 mol/L ,c(X)=0.2 mol/L, c(Y)=0.3mol/L, c(W)=0.15 mol/L;
4X(g) + 5Y(g) ![]() nZ(g ) + 6W(g)
nZ(g ) + 6W(g)
起始量 0.2 0.3 0 0
变化量 0.1 0.125 0.1 0.15
剩余量 0.1 0.175 0.1 0.15
(1)v(W)=0.15/2=0.075mol/(L·min);正 确 答 案:0.075mol/(L·min)。
(2)C(Y)=0.3-0.125= 0.175 mol/L;正 确 答 案:0.175mol/L。
(3)根 据 方 程 式 比 例 关 系:n:6=0.1:0.15,n=4;正 确 答 案:4。
(4)在其他条件不变的情况下,反应前后气体的压强之比等于反应前后气体的总量之比,P(后):P(前)=(0.1×2+0.175×2+0.1×2+0.15×2):(0.4+0.6)=1.05:1;正 确 答 案:1.05。


科目:高中化学 来源: 题型:
【题目】生物大分子在生物体的生命活动中具有重要作用,就组成生物蛋白质、核酸、糖类、脂肪而言,最基本的元素是( )
A. C B. H C. O D. N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定FeSO4溶液置于空气中是否变质,所选检验试剂能达到目的是( )
A. NaOH溶液 B. KSCN溶液 C. BaCl2溶液 D. 硝酸钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液 (二甲胺在水中的电离与氨相似,在常温下Kb[(CH3)2NH·H2O]=1.6×10-4 )。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. D点溶液中:2c(Na+)=3c(Cl-)
B. A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C. 曲线②代表滴定二甲胺溶液的曲线
D. 在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.形成离子键的阴、阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第3周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2的燃烧热是akJ/mol,由H2、CO按3:1比例组成的混合物2mol,完全燃烧并恢复到常温吋,放出的热量为bkJ,则CO的燃烧热为(kJ/mol)为( )
A.2b﹣3a
B.3a﹣2b
C.![]() (2b﹣3a)
(2b﹣3a)
D.![]() (a﹣2b)
(a﹣2b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基烯酸酯在碱性条件下能快速聚合为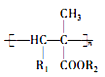 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
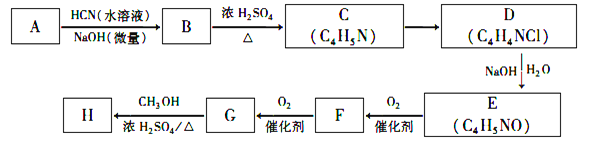
已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;

回答下列问题:
(1)A的化学名称为____________。
(2)G的结构简式为________________,G中的含氧官能团是________________。(填官能团名称)
(3)由B生成C的反应类型为_______________,由C生成D的反应类型为_____________。
(4)由E生成F的化学方程式为________________________________。
(5)H的同分异构体中,含有酯基,能发生银镜反应、核磁共振氢谱之比是1:1:3的同分异构体结构简式_____________________________________________。(写两种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( ) 
A.8 min时表示正反应速率等于逆反应速率
B.前20 min A的反应速率为0.05 molL﹣1min﹣1
C.反应方程式中的x=1,30 min时表示增大压强
D.40 min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 都为短周期元素,A 原子失去一个电子后成为一个质子;C 的-1 价阴离子与氖原子具有相同的电子层结构;D在C 的下一周期,D可与同周期的B形成 BD2型离子化含物;E 和 C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是____________。
(2)A与 E 形成的最简单化合物的电子式为____________。
(3)C的氢化物与 D的氢化物的沸点相比较: ____________(用化学式表示,且用>符号连接)。 解释原因______________。
(4)E 的氢化物与 E 的最高价氧化物对应水化物反应的生成物中含有的的化学键有____________。
(5)E 的最高价氧化物对应的水化物的稀溶液与过量铁粉发生反应的离子方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com