
| A. | HCl晶体溶于水 | B. | 在氧气中点燃氢气 | ||
| C. | 冰熔化为液态水 | D. | NaCl晶体受热熔化 |
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | ④>①>③>② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ①=④>③=② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
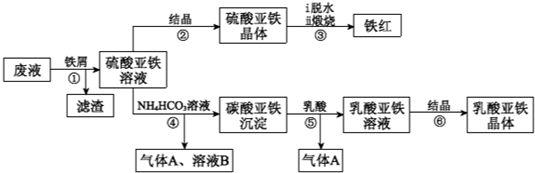
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Ca是第4周期、第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱 | |
| B. | 已知As是第4周期、第VA族的元素,故AsH3的稳定性比NH3的稳定性强 | |
| C. | 已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈 | |
| D. | 已知Cl的核电荷数比F的核电荷数大,故Cl的原子半比F的原子半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2、${\;}_{1}^{3}$H2 | B. | ${\;}_{6}^{12}$C、${\;}_{6}^{14}$C | ||
| C. | D2O、H2O | D. | 金刚石、石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
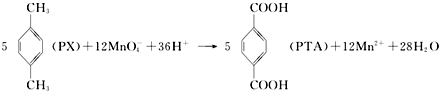
| A. | PTA是该反应的氧化产物 | |
| B. | PTA与乙二醇通过加聚反应即可生产PET塑料 | |
| C. | PX分子含有苯环的同分异构体还有3种 | |
| D. | 该反应消耗 1molPX,共转移12NA个电子 (NA为阿伏加德罗常数) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com