
| c��H+�� | c��S
| c��Fe2+��Fe3+�� | ||
| O | 2- 4 |
| ||
| ||
| ||
| 0.2L |
| 8.0g |
| 160g/mol |
| 0.05mol��2 |
| 0.2L |
| 0.1mol/L |
| 0.5mol/L |
| 1 |
| 2 |
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 2 |
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 2 |
| 2 |
| 3 |
| 1 |
| 3 |


 ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д� �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CF2Cl2 |
| B��C3H6 |
| C��C6H12O6 |
| D��C2H4O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| NaCN |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
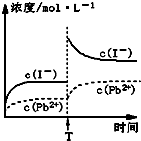 ȡһ������PbI2����������ˮ��ɱ�����Һ����ȡ25.00mLPbI2������Һ���ִ�������R-H��s���������·�Ӧ��Pb2+��aq��+2R-H��s��=R2Pb��s��+2H+��aq������ַ�Ӧ���ˣ�����ƿʢװ��Һ������������ˮϴ�ӳ�������ϴ��Һһ��������ƿ�У�����ָʾ������0.0025mol/LNaOH��Һ�ζ������ﵽ�ζ��յ�ʱ����ȥ����������Һ20.00mL���������ʵ�����ݣ������й�˵����ȷ���ǣ�������
ȡһ������PbI2����������ˮ��ɱ�����Һ����ȡ25.00mLPbI2������Һ���ִ�������R-H��s���������·�Ӧ��Pb2+��aq��+2R-H��s��=R2Pb��s��+2H+��aq������ַ�Ӧ���ˣ�����ƿʢװ��Һ������������ˮϴ�ӳ�������ϴ��Һһ��������ƿ�У�����ָʾ������0.0025mol/LNaOH��Һ�ζ������ﵽ�ζ��յ�ʱ����ȥ����������Һ20.00mL���������ʵ�����ݣ������й�˵����ȷ���ǣ�������| A���Է�̪Ϊָʾ��ʱ���ζ����յ�ʱ��Һ�ɺ�ɫ��Ϊ��ɫ |
| B�����¶Ȳ���ʱ����PbI2������Һ�м�����������ǦŨ��Һ��PbI2��Ksp��С |
| C���¶Ȳ��䣬Tʱ�̣���PbI2������Һ�м�������KIŨ��Һ������Ũ�ȱ仯����ͼ��ʾ |
| D������ʵ���õ�t��PbI2��Ksp=4��10-9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����ʳƷ���Ӽ�������ԭ�ϣ���ϳ�·�����£�
����ʳƷ���Ӽ�������ԭ�ϣ���ϳ�·�����£�

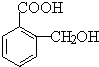 ����һ�������¿��Ժϳɾ����߷��ӣ�д���þ����߷��ӵĽṹ��ʽ
����һ�������¿��Ժϳɾ����߷��ӣ�д���þ����߷��ӵĽṹ��ʽ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com