
【题目】ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂,制备ClO2的新工艺是电解法。
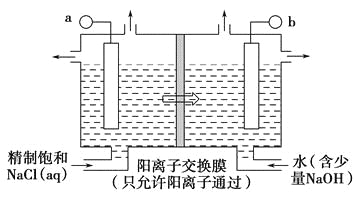
(1)如图表示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极方程式:__________________________________;图中b电极为_____________(填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol,阴极区pH________(填“变大”“变小”或“不变”)。
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________________。
【答案】Cl--5e-+2H2O=ClO2↑+4H+ 阴极 0.01 变大 2ClO2+2CN-=N2+2CO2+2Cl-
【解析】
(1)在一定条件下电解饱和食盐水制取ClO2,可知氯离子放电生成ClO2,由元素守恒可知,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+;由图可知,阳离子移向b极,则b为阴极;
(2)阴极发生2H++2e-=H2↑,产生氢气的物质的量为0.112L÷22.4L/mol=0.005mol,通过阳离子交换膜的阳离子为+1价离子,所以通过交换膜的阳离子的物质的量为0.005mol×2=0.01mol,阴极H+浓度减小,溶液的pH变大;
(3)ClO2将CN-氧化成两种无毒气体,则应生成氮气与二氧化碳,反应离子方程式为2ClO2+2CN-=N2+2CO2+2Cl-。


科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有乙烷、乙烯、环己烷、苯四种有机物,有关说法错误的是
A.环己烷和苯都可以萃取溴水中的溴
B.等质量的苯比乙烯完全燃烧生成的二氧化碳更多
C.除去乙烷中的乙烯最好通过稀溴水
D.环己烷和苯的所有原子均在同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下
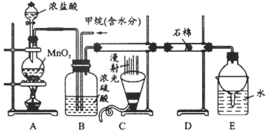
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③____________________________。
(2)设![]() =x,若理论上欲获得最多的氯化氢,则x值应__________。
=x,若理论上欲获得最多的氯化氢,则x值应__________。
(3)D装置的石棉中均匀混有KI粉末,其作用是________________。
(4)E装置的作用是__________(填编号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为________________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为__________(填编号)。
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. Si、P、S、Cl相应的最高价氧化物对应水化物的酸性依次增强
B. 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
C. 工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质[
D. 钠与氧气反应的产物与反应条件无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素Ⅹ、Y、Z、W的原子序数依次增大,Ⅹ、W同主族且W原子核电荷数等于X原子核电荷数的2倍,Y、Z原子的核外电子数之和与Ⅹ、W原子的核外电子数之和相等。下列说法中一定正确的是
A. Ⅹ的原子半径比Y的原子半径大
B. Ⅹ形成的氢化物分子中不含非极性键
C. Z、W的最高价氧化物对应的水化物是酸
D. Y单质与水反应,水可能作氧化剂也可能作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() X表示原子:
X表示原子:
①AXn+共有x个电子,则该阳离子的中子数N=____。
②12C16O2分子中的中子数N=______。
③A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为_____。
(2)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是_____。
(3)已知某粒子的结构示意图为![]()
试回答:①当x-y=10时,该粒子为___(填“原子”、“阳离子”或“阴离子”)。
②写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是
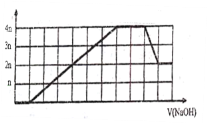
A. 原溶液中一定含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42-和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中含有的溶质仅为Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com