
【题目】某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中不正确的是

A. 实验前pH(Na2CO3)>pH(NaHCO3)
B. 实验后两溶液中离子种类完全相同
C. Na2CO3溶液中生成的沉淀比NaHCO3溶液中生成的沉淀多
D. 两溶液中反应的基本类型相同
【答案】B
【解析】
A、CO32-、HCO3-水解均显碱性,相同浓度下,CO32-的水解程度比HCO3-大,所以相同浓度的Na2CO3溶液的pH大于NaHCO3溶液,故A不符合题意;
B、实验后,碳酸钠溶液和氯化钙溶液恰好反应,生成碳酸钙钙沉淀和氯化钠,其中的离子主要有:钠离子、氯离子;碳酸氢钠溶液和氯化钙溶液反应后,生成碳酸钙沉淀和氯化钠、碳酸,碳酸大部分分解为二氧化碳气体和水,氯化钙有剩余,溶液中的离子主要有:钠离子、氯离子、钙离子、碳酸氢根等,故两者的离子种类不相同,故B符合题意;
C、加入氯化钙后,左侧试管中只有白色沉淀生成,则反应方程式为Na2CO3+CaCl2=CaCO3![]() +2NaCl,右侧试管中有白色沉淀和无色气体产生,则反应方程式为2NaHCO3+CaCl2=CaCO3
+2NaCl,右侧试管中有白色沉淀和无色气体产生,则反应方程式为2NaHCO3+CaCl2=CaCO3![]() +2NaCl+CO2+H2O ,由方程式可知起始CO32-、HCO3-的物质的量相同时,生成的沉淀不一样多,故C不符合题意;
+2NaCl+CO2+H2O ,由方程式可知起始CO32-、HCO3-的物质的量相同时,生成的沉淀不一样多,故C不符合题意;
D、根据C项分析可知,两试管中发生的反应均为复分解反应,故D不符合题意。
综上所述,本题应选B。


科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P—P:198 P—O:360 O=O:498;则反应P4(白磷)+3O2===P4O6的能量变化为( )

A.释放1638 kJ的能量
B.吸收1638 kJ的能量
C.释放126 kJ的能量
D.吸收126 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列递变规律正确的是( )
A. HClO4、H2SO4、H3PO4的酸性依次增强 B. 钠、镁、铝的还原性依次减弱
C. HCl、HBr、HI的稳定性依次增强 D. P、S、Cl原子半径逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、X、W、D、E为短周期元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物可使湿润的红色石蕊试纸变蓝, A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)W的原子结构示意图为________。
(2)A、W两种元素能形成含18电子的分子,请写出该分子的电子式:_______________。用电子式表示化合物D2W的形成过程______________________。
(3)下列事实能说明W元素的非金属性比S元素的非金属性强的是________ (填字母)。
a.W单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol W单质比1 mol S得电子多
c.W和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X的最高价氧化物对应水化物与其简单气态氢化物所形成的化合物中含有的化学键类型是_______
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:________________________。
②每生成1 mol FeO42-转移________ mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________ mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),原因是________________________________________________________________。
(2)地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的化学方程式为[用Fe和HNO3(稀)反应表示]______________________________________。
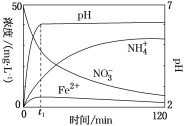
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B,B能与纯碱反应。已知:
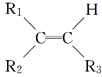
![]()
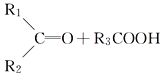
则符合上述条件的烃A有________种(不考虑顺反异构)( )
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=________。
(2)一定温度下,CdCO3的Ksp=4.0 × 10-12,Cd(OH)2的Ksp=3.2 × 10-14,那么它们在水中的溶解量________较大。
(3)在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Ar(Cd)=112);此时是否符合水源标准?______(填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
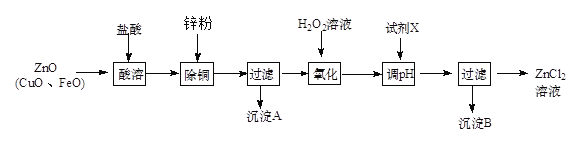
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
(1)加入H2O2溶液的作用是________________。
(2)流程图中,调节pH时,加入的试剂X可以是________(填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是 ( )
A. 2.24g B. 3.36g C. 5.60g D. 10.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )
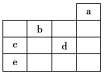
A. 元素b位于第ⅥA族,有+6、-2价两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c>d
D. 元素c和e的气态氢化物的稳定性:c>e
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com