
【题目】下列说法正确的是
A. 1 mol O2的质量是32g/mol
B. 阿伏加德罗常数的准确值就是6.02×1023
C. CO2的摩尔质量是44g/mol
D. 常温常压下22.4L氦气含有1 mol原子
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]硼及其化合物用途非常广泛,回答下列问题。
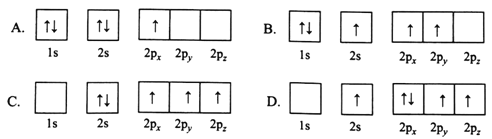
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
(2)H3BO3是一元弱酸,可用作医用消毒剂其水溶液呈酸性的原理为:
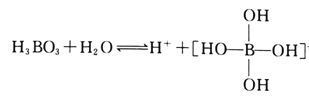
则1mol硼酸分子中含有的共用电子对数为________个。
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是________________,硼原子杂化方式是________________;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是________________________________。
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含________个σ键。
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。
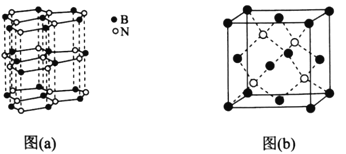
①六方BN具有良好的润滑性,是因为________________________;六方BN不能像石墨一样具有导电性,其原因是________________________。
②已知立方BN的晶胞参数为0.3615nm,阿伏加德罗常数的值为NA,则立方BN的密度为________________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 2NO2(g)![]() N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是
N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成 n mol N2O4 的同时生成 2n mol NO2
②单位时间内消耗 n mol N2O4的同时生成 2n mol NO2
③用NO2、N2O4的物质的量浓度变化表示的反应速率的比为2:1 的状态
④混合气体的颜色不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A. ①④⑤B. ②⑤C. ①③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是( )

A. I为负极,其电极反应式为Ag+Cl-+e-=AgCl
B. “水”电池内Na+不断向负极作定向移动
C. 每转移1mole-,U型管中消耗0.5molH2O
D. “水”电池内,每生成1molNa2Mn5O10,X电极上生成1mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是
2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)>1.4mol
C. 若反应开始时容器容积为2L,则v(SO3)=0.35mol·L-1·min-1
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量小于Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题
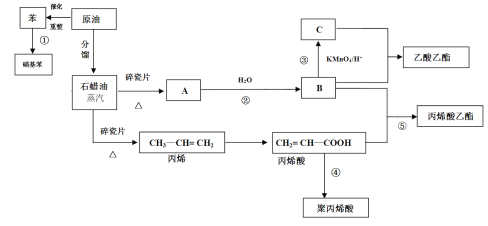
(1)C的结构简式为________。
(2)丙烯酸中含氧官能团的名称为_____________。
(3)③④反应的反应类型分别为_____________、___________。
(4)写出下列反应方程式
①反应①的化学方程式____________;
②反应②的化学方程式_________________;
③反应⑤的化学方程式____________。
(5)丙烯酸(CH2 = CH — COOH)可能发生的反应有_______________(填序号)
A 加成反应 B 取代反应 C 加聚反应 D 中和反应 E 氧化反应
(6)丙烯分子中最多有______个原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在生产、生活中有广泛的应用,按要求回答问题:
(1)CO2可通过反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)转化成有机物实现碳循环。一定条件下,在体积为1 L的密闭容器中,充入 1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)转化成有机物实现碳循环。一定条件下,在体积为1 L的密闭容器中,充入 1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从3 min到9 min内,v(H2)=_____mol·L1·min1。平衡时H2的转化率为________。平衡时混合气体中CO2(g)的体积分数是________。一定温度下,第9分钟时v逆(CH3OH) _______第3分钟时v正(CH3OH)(填“大于”、“小于”或“等于”)。
(2)如图,将锌片、C棒通过导线相连,置于稀硫酸中。

该装置工作时,溶液中的SO42-向____极(填“C”或“Zn”)移动;电子沿导线流入_______极(填“C”或“Zn”)。写出正极的电极反应式____。若正极产生11.2L气体(标况下),则电路中应该有___mol电子发生了转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )

A. 升高温度能使![]() 增大
增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:

(1)写出该反应的平衡常数表达式为__________________.
(2)上述合成甲醇的反应为________反应(填“放热”或“吸热”). A、B、C三点的平衡常数KA、KB、KC的大小关系为____________.A、B两点对应的压强大小关系是PA________PB(填“大于”、“小于”或“等于”).
(3)若反应达到平衡状态A时,保持容器体积及体系温度不变,再向容器中充入2mol CO(g)、4molH2(g)、 2molCH3OH(g)则平衡向______方向移动(填“正”或“逆”)
(4)通常状况下取一定量的甲醇充分完全燃烧生成27克的水,放出热量544.35KJ,请写出表示甲醇燃烧热的热化学反应方程式_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com