
【题目】合成氨反应过程中的能量变化如图所示,下列说法错误的是( )

A. 反应体系中加入催化剂,不会改变反应的热效应
B. 反应物的总能量高于生成物的总能量
C. 该反应的热化学方程式为3H2+N2![]() 2NH3 ΔH=Q(Q>0)
2NH3 ΔH=Q(Q>0)
D. 该反应是放热反应
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】Glaser反应在研究新型发光材料、超分子化学等方面具有重要价值。一定条件下丙炔(CH≡CCH3)发生Glaser反应制备CH3C≡C—C≡CCH3时,主要副产物为CH3CH2CH3,发生的反应为
I.2CH≡CCH3(g)![]() CH3C≡C—C=CCH3(g)+H2(g) △H1=+60 kJ·mol-1
CH3C≡C—C=CCH3(g)+H2(g) △H1=+60 kJ·mol-1
II.CH≡CCH3(g)+2H2(g)![]() CH3CH2CH3(g) △H2=-179kJ·mol-1
CH3CH2CH3(g) △H2=-179kJ·mol-1
请回答:
(1)反应II的平衡常数表达式K=__________。
(2)为提高CH3C≡C—C=CCH3的产率,可采取的措施为______(任写两条)。
(3)己知:C—H、H —H 的键能分别为414 kJ·mol-1、436 kJ·mol-1,则C—C 的键能为____ kJ·mol-1。
(4)欲提高反应I的速率,向其中加入傕化剂,使该反应分两步进行,且均为吸热反应。下如图为未加催化剂时反应I的能量变化图,请画出加入催化剂后反应过程的能量变化图_____________。
(5)一定温度下,向某恒容密闭容器中充人一定量的CH≡CCH3(g)+2H2(g),发生反应II。一段时间内测定CH3CH2CH3(g)与H2(g)的消耗速率,二者关系如下如图中AB曲线所示。B点时,该反应_________(填“是”或“否”)达到平衡状态,原因为_____________;若此时升高温度,二者速率关系相应的点可能为______________(填字母)。
(6) CH3CH2CH3碱性燃料电池是一种高性能燃料电池,其工作原理如下如图所示。b电极为________(填“正极”或“负极”),该电极的反应式为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,可制得Cl2的正确组合是( )
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热 ③NaClO和浓盐酸混合 ④K2Cr2O7和浓盐酸混合 ⑤KClO3和浓盐酸混合共热 ⑥KMnO4和浓盐酸混合
A. ①②⑥ B. ②④⑥
C. ①④⑥ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用足量的MnO2和含有4 mol溶质的浓盐酸充分反应制氯气,下列说法正确的是( )
A. 该实验中共消耗1 mol MnO2,生成1 mol氯气
B. 为了除去氯气中混有的杂质气体,可以依次通过饱和食盐水和碱石灰
C. 在该反应中MnO2作氧化剂,浓盐酸作还原剂
D. 氯气可以用向上排空气法或排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种细菌在酸性水溶液中,有氧气的情况下,可以将黄铜矿(主要成分是CuFe![]() ,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
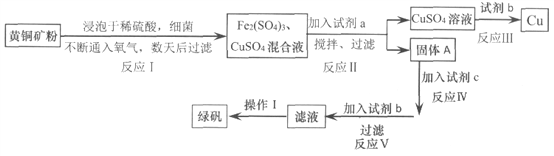
已知:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
回答下列问题:
(1)试剂a是_________,调节溶液的pH值,为使Fe3+完全沉淀,合适pH的范围是_______。
(2)试剂b为________,请写出反应III的离子方程式________________。
(3)固体A成份是________。
(4)欲从滤液中获得绿矾晶体,操作I应为________________、洗涤干燥。
(5)反应I中参加反应的n(CuFeS2):n(O2)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰锌铁氧体可用于隐形飞机上吸收雷达波涂料。现以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下:

(1)碱性锌锰干电池(电解质为 KOH)中 MnO2参与反应的电极反应式为______________________。
(2)用硫酸酸浸时,为了提高浸取率可采取的措施有________________________(任写一点)。酸浸时,二氧化锰被双氧水还原的化学方程式为___________________。
(3)活性铁粉除汞时,铁粉的作用是______________ (填“氧化剂” 或“还原剂” 或“吸附剂” ) 。
(4)除汞是以氮气为载气吹入滤液带出汞蒸汽经 KMnO4溶液进行吸收而实现的。 在不同pH下,KMnO4溶液对Hg的吸收率的影响及主要产物如图所示。

①请根据该图给出 pH对汞吸收率影响的变化规律: __________________________。
②试分析在强酸性环境下 Hg 的单位时间吸收率高的原因可能是: _______________。
(5)经测定滤液成分后同时加入一定量的 MnSO4和铁粉的目的是________________。
(6)当 x=0.2 时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该铁氧体组成_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程能量变化如下所示:H2(g)+Cl2(g)===2HCl(g) ΔH
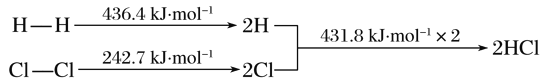
下列说法错误的是( )
A. H—H键比Cl—Cl键稳定
B. 正反应活化能比逆反应活化能高
C. ΔH=-184.5 kJ·mol-1
D. 在相同条件下,1 mol H2(g)和1 mol Cl2(g)分别在点燃和光照条件下反应生成2 mol HCl(g),重新恢复到原来的状态时ΔH相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com