
以下电离方程式错误的是
A.NaOH=Na++OH- B.Fe2(SO4)3=2Fe3++3SO42-
C.MgCl2=Mg2++2Cl- D.NaHCO3=Na++H++CO32-
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:2016-2017学年吉林长春外国语学校高一上期末文化学卷(解析版) 题型:选择题
下列离子能跟H+大量共存的是
A、OH- B、CO32- C、SO32- D、SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林长春外国语学校高二上期末化学试卷(解析版) 题型:选择题
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H++2e-=H2 B.Fe2++2e-=Fe
C.2H2O+O2+4e-=4OH- D.Fe3++e-=Fe2 +
+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上学期期末化学试卷(解析版) 题型:选择题
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原矿石中Al2O3的质量是()克
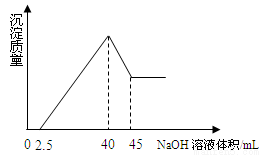
A. 5.1 B.3.9 C. 2.55 D. 7.8
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上学期期末化学试卷(解析版) 题型:选择题
将Cu放入0.1 mol•L﹣1FeCl3溶液中,反应一段时间后取出Cu片,溶液中 Fe3+与Fe2+的物质的量浓度之比为4:3,则反应后溶
Fe3+与Fe2+的物质的量浓度之比为4:3,则反应后溶 液中Cu2+与Fe3+的物质的量之比为
液中Cu2+与Fe3+的物质的量之比为
A.3:2 B.3:8 C.4:3 D.3:4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:填空题
食醋的总酸量即一定体积的食醋原液所含醋酸的质量,单位是g· L-1或个g/100mL。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)用酸碱滴定法测定某食醋样品中的总酸量时,下列说法中正确的是 。
A.用NaOH溶液滴定时反应的离子方程式为H++OH-=H2O
B.食醋样品不需要预先稀释一定倍数后可以直接进行滴定
C.用NaOH溶液滴定时,可使用酚酞或甲基橙作指示剂
D.若测得样品的物质的量浓度为0.75mol·L-1,则其总酸量为45g·L-1
(2)某同学仔细观察该食醋样品的标签,发现其中还含有作为食品添加剂的苯甲酸钠(C6H5COONa),他想用理论验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下醋酸与苯甲酸的 。
A.pH B.电离度 C.电离常数 D.溶解度
(3)常温下,用0.1000mol· L-1 NaOH溶液分别滴定20.00mL 0.1000mol· L-1 HCl溶液和20.00mL 0.1000mol· L-1 CH3COOH溶液,得到两条滴定曲线,如图所示。
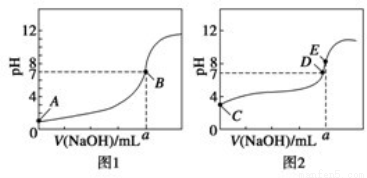
①滴定醋酸溶液的曲线是 (填“图1”或“图2”);滴定曲线中a= mL;
②E点pH>8的原因是(用离子方程式表示): 。
(4)测定食醋的总酸量实验中,配制NaOH溶液和稀释食醋所用的蒸馏水必须煮沸,目的是 。
(5)实验时,吸取食醋样品10mL于100mL容量瓶中定容。移取定容后的溶液20mL于锥形瓶中,加入1~2滴指示剂,用浓度为c mol·L-1的NaOH标准溶液滴定,平行测定三次,消耗NaOH溶液的平均体积为V mL。则原食醋样品的总酸量=____________g/100mL。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:选择题
对于aX(g)+bY(g)?cZ(g),为探索外界条件的影响,以X和Y物质的量比为a︰b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如右图所示.以下判断正确的是( )
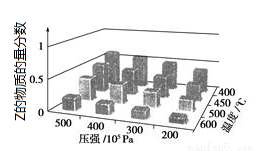
A.△H>0,a+b>c B.△H>0,a+b<c
C.△H<0,a+b>c D.△H<0,a+b<c
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期教学质检化学试卷(解析版) 题型:选择题
下列分子中的中心原子杂化轨道的类型相同的是( )
A.BeCl2与BF3 B.CO2与SO2
C.CCl4与NH3 D.C2H2和C2H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com