
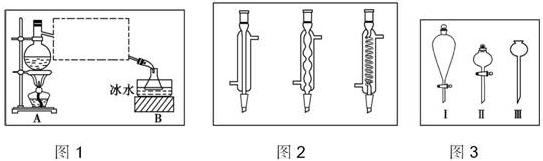
分析 (1)乙醚的制备过程中要测量反应溶液的温度,而精制过程中需要测量蒸出物的沸点,蒸馏装置中冷凝管是横斜放着的,故用直形冷凝管;
(2)浓硫酸溶于水放出大量热,应将浓硫酸倒入其他液体;
(3)①制得的乙醚中含有一定量硫酸、乙醇,硫酸溶于水;②乙醇和水都能被无水氯化钙吸收;
(4)浓硫酸使乙醇脱水炭化,并放出刺激性气味的气体.
解答 解:(1)乙醚的制备过程中要测量蒸出物的沸点,水银球位置在蒸馏烧瓶的支管处,冷凝管是横斜放着的,故用直形冷凝管,
故答案为:支管口处;直形冷凝管;
(2)混合浓硫酸与乙醇的方式是将将浓硫酸倒入其他液体;
故答案为:浓硫酸;
(3)①乙醚难溶于水.水洗的目的是除去多余的硫酸和乙醇,用梨形分液漏斗分液;
故答案为:除去多余的硫酸和乙醇;I;
②无水氯化钙吸收水和乙醇,故用无水CaCl2干燥,
故答案为:无水CaCl2;
(4)浓硫酸使乙醇脱水炭化,并放出刺激性气味的气体,反应为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:乙醇被炭化;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
点评 本题通过考查乙醚的制取,考查了制备方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,注意熟练掌握化学实验基本操作方法,明确制备方案的设计与评价原则,试题培养了学生的分析能力及化学实验能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
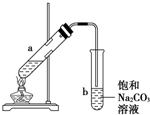 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 可将饱和碳酸钠溶液换成氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数不变 | B. | n(O2)增大 | ||
| C. | SO2的体积分数增大 | D. | c(SO2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 明矾净水时使水中悬浮颗粒沉淀 | |
| B. | 清晨树林中的道道光柱 | |
| C. | 雾霾天气打手电能看到明显的光柱 | |
| D. | 澄清石灰水中通入CO2气体,有白色的沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
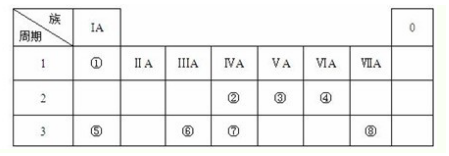
 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
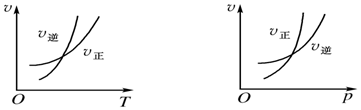
| A. | m>n,Q>0 | B. | m>n+p,Q>0 | C. | m>n,Q<0 | D. | m>n+p,Q>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com