
分析 (1)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子;
(1)反应中Mn元素化合价由+4价变为+2价、部分Cl元素化合价由-1价变为0价;
(3)反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,转移电子数为12;
(4)反应2H2S+SO2═3S↓+2H2O中硫元素的化合价变化为:由+4价、-2价分别变为0价,该反应中氧化产物和还原产物都是硫单质.
解答 解:(1)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,
,
故答案为: ;
;
(2)该反应中Mn元素化合价由+4价变为+2价、部分Cl元素化合价由-1价变为0价,所以氧化剂是MnO2,还原剂对应的产物氯气是氧化产物,被氧化的元素是Cl、被还原是元素是Mn,该反应中有一半的HCl作还原剂、一半的起酸的作用,所以被氧化的HCl与参加反应的HCl物质的量之比是1:2,该反应中转移电子数为2,电子转移方向和数目为 ,故答案为:
,故答案为: ;
;
(3)应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,转移电子数为12,用单线桥表示电子转移的情况为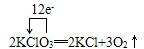 ,
,
故答案为: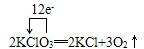 ;
;
(4)反应中H2S中S氧化化合价升高,由-2价升高到0价,SO2中S元素化合价降低,由+4价降低到0价,氧化还原反应反应中得失电子数目相等,表现为化合价升降的总数相等,为 ,故答案为:
,故答案为: .
.
点评 本题考查较为综合,全面考查氧化还原反应知识,注意把握元素化合价的变化,明确电子转移的数目和方向,根据化合价的升降总数计算电子转移的数目,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol甲烷中的氢原子被氯原子完全取代,需要2NACl | |
| B. | 1mol•L-1Mg(NO3)溶液中含有NO3-的数目为2NA | |
| C. | 标准状况下.22.4LBr2中所含的分子数为NA | |
| D. | Na2O2与水反应时,每生成0.1 molO2,转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com