
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

回答下列问题:
(1)用于文物年代测定的元素,其核素符号为_________。元素z在周期表中的位置是____________。
(2)元素d、e、f、g原子的简单离子半径由大到小的顺序为_________(用离子符号表示)。
(3)元素f的单质与元素e的最高价氧化物对应的水化物反应的化学方程式为___________________。
(4)元素h单质的氧化性强于元素g单质的氧化性的事实是___________(用离子方程式表示)。
【答案】614C 第2周期第VA族 S2->O2﹣>Na+>Al3+ 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ S2-+Cl2=2Cl-+S↓或H2S+Cl2=2H++2Cl-+S↓
【解析】
从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,据此分析解答。
(1)能用于文物年代测定的是14C,其核素的符号为:614C,z元素为氮元素,位于周期表中的第2周期第VA族,故答案为::614C、第2周期第VA族;
(2)元素d、e、f、g原子的简单离子分别是:O2-、Na+、Al3+、S2-,其中S2-核外有三个电子层,半径最大,O2-、Na+、Al3+三种离子的电子层结构相同,核电荷数越大离子半径越小,所以r(O2﹣)>r(Na+)>r(Al3+),故答案为:S2->O2﹣>Na+>Al3+;
(3)f是Al元素,元素e的最高价氧化物对应的水化物为NaOH,两者反应的方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑,故答案为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑;
(4)元素h为氯元素,元素g为硫元素,氯元素的非金属性较硫强,所以氯气的氧化性强于硫,能与硫化钠溶液或氢硫酸反应得到硫单质,反应的离子反应为:S2-+Cl2=2Cl-+S↓或H2S+Cl2=2H++2Cl-+S↓,故答案为:S2-+Cl2=2Cl-+S↓或H2S+Cl2=2H++2Cl-+S↓。


科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会和环境密切相关。下列有关说法中不正确的是
A. 对废旧电池进行回收处理,主要是为了环境保护和变废为宝
B. 用电解水的方法制取大量![]() ,可以缓解能源不足的问题
,可以缓解能源不足的问题
C. 大力开发和应用太阳能有利于实现“低碳经济”
D. 工业上,不能采用电解![]() 溶液的方法制取金属镁
溶液的方法制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对维持生物体正常生命活动必不可少的微量元素是
A. Fe、Mn、Zn、Mg
B. Zn、Cu、Mn、Ca
C. Mg、Mn、Cu、Mo
D. Zn、Cu、B、Mn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求,回答下列问题。
(1)选择下面的实验装置能完成相应的实验:
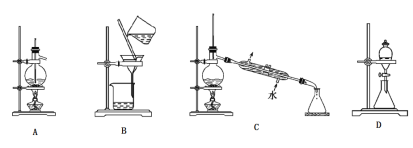
实验室制取乙烯到的装置是_____(填写序号,下同);分离苯和甲苯的装置是_________;提纯苯甲酸过程中进行分离操作用到的装置是_________;用CCl4萃取溴水中的溴用到的装置是_________。
(2)以下是五种常见有机物分子模型示意图,其中A、B、C为烃, D、E为烃的含氧衍生物。

鉴别A和B的试剂为__________;上述物质中有毒、有特殊气味,且不溶于水、密度比水小的液体是__________(填名称);D分子中的官能团是________;鉴别E的试剂可以选用______________。
(3)写出下列化学方程式:
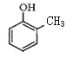 与足量溴水反应_____________________________________________;
与足量溴水反应_____________________________________________;
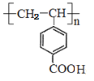 与足量NaOH溶液反应_______________________________。
与足量NaOH溶液反应_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是![]()
![]()
①含有金属元素的化合物一定是离子化合物
②第ⅠA族和第ⅦA族原子化合时,一定生成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与非金属化合时,能形成离子键
⑤含有离子键的化合物一定是离子化合物
⑥离子化合物中可能同时含有离子键和共价键
⑦非极性键只存在于双原子单质分子中
⑧不同元素组成的多原子分子中的化学键一定都为极性键
A. ①②⑤B. ④⑤⑥C. ①③④D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯中,可观察到锌片逐渐溶解,并有气泡产生;平行地插入一块铜片(如图甲装置所示),可观察到铜片上___ (填“有”或“没有”)气泡产生;若用导线把锌片和铜片连接起来(如图乙装置所示),可观察到铜片上____ (填“有”或“没有”)气泡产生。
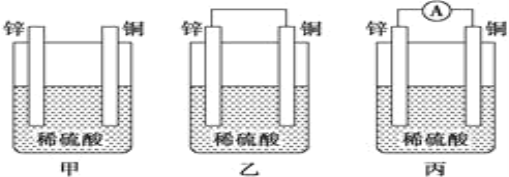
(2)乙、丙装置是将_____能转化为____能的装置,人们把它叫做________。
Ⅱ.将质量相等的锌片和铜片用导线相连,并浸入500 mL硫酸铜溶液中构成如图所示的装置。

(1)该装置中总反应的离子方程式为____________,铜片周围溶液会出现_________的现象。
(2)若2 min后测得锌片质量减少1.3 g,则导线中流过的电子为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是一种挥发油,可从植物果实中提取,具有抗菌、解痉、镇静的作用,其结构简式为CH2=CH-CH2![]() OH。
OH。
(1)胡椒酚的分子式是_______。
(2)胡椒酚所含官能团的名称是_______、_______。
(3)胡椒酚与NaOH溶液反应的化学方程式是_______。
(4)1 mol胡椒酚与H2发生加成反应,理论上最多消耗_______ mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com