


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
| A、NaHSO4溶液中:c( Na+)>c(HSO4-)>c( H+)>c(SO42-)>c( OH-) |
| B、0.1mlo/L H2SO4溶液中c( H+)=0.11mlo/L |
| C、Na2SO3溶液显碱性是因为SO32-+H2O?HSO3-+OH- |
| D、H2SO4溶液和NaHSO4溶液中,HSO4-的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、③ | B、② | C、②和④ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
如图,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
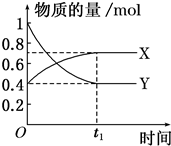
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 25 | 50 | 95 | |
| 溶解度(g) | 氯化钠 | 36.0 | 37.0 | 39.0 |
| 苯甲酸 | 0.17 | 0.95 | 6.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
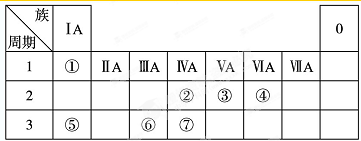
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅是生产光纤制品的基本原料 |
| B、铝热反应可用于焊接铁轨 |
| C、盐析可提纯蛋白质并保持其生理活性 |
| D、常温下可用铁罐槽车运输浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com