
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1×10-12 |
| 0.1 |


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
A、质量数为37的氯原子:
| ||
B、二氧化碳分子的比例模型: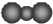 | ||
C、NH4Br的电子式: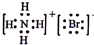 | ||
D、对羟基苯甲醛的结构简式: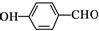 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |
| Z | W |
| A、原子半径:W>Z>Y>X |
| B、最高价氧化物对应水化物的酸性:Z>W>X |
| C、气态氢化物的沸点:Y>Z |
| D、四种元素的单质中,W单质的熔、沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某中学环境监测兴趣小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如右图所示.这些厂往小河里排放的废水中各含一种化合物.经检测发现:①甲处河水呈浅黄色;②乙处河水呈红褐色浑浊状;③丙处河水逐渐变澄清;④丁处河水不断冒气泡;⑤M处水样的pH大于7,加入足量的稀HNO3后再加入BaCl2溶液,无沉淀生成;⑥N处水样的pH小于7.请回答:
某中学环境监测兴趣小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如右图所示.这些厂往小河里排放的废水中各含一种化合物.经检测发现:①甲处河水呈浅黄色;②乙处河水呈红褐色浑浊状;③丙处河水逐渐变澄清;④丁处河水不断冒气泡;⑤M处水样的pH大于7,加入足量的稀HNO3后再加入BaCl2溶液,无沉淀生成;⑥N处水样的pH小于7.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于 | B、小于 |
| C、等于 | D、不能肯定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL 0.2mol?L-1MgCl2溶液 |
| B、20 mL 0.5 mol?L-1 AgNO3溶液 |
| C、40 mL 0.3mol?L-1HCl溶液 |
| D、15 mL 0.1mol?L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有以下几种中学化学中常见物质:钠、铁、氧化钠、过氧化钠、二氧化硫、二氧化氮,根据它们在一定条件下能否与H2O发生氧化还原反应进行的分类如图,请回答下列问题:
现有以下几种中学化学中常见物质:钠、铁、氧化钠、过氧化钠、二氧化硫、二氧化氮,根据它们在一定条件下能否与H2O发生氧化还原反应进行的分类如图,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com