
【题目】如图1是某同学在实验室中进行铝热反应(铝过量)的实验装置,实验中他观察到的现象之一为“纸漏斗的下部被烧穿,有熔融物落入沙中”。

(1)写出该反应的化学方程式:________________________________________________。
(2)为检验铝热反应后的固体成分,请填写下表:
检验成分 | 操作步骤 | 实验现象与结论 |
铝 | ____________ | ___________ |
氧化铁 | _____________ | ____________ |
(3)探究铝热反应后固体的性质:将反应后容器中的固体残余置于烧杯中,加入一定量稀硝酸,固体完全溶解,反应过程中无气体放出(活泼金属可把稀HNO3)还原为NH4NO3)。在反应后的溶液中缓慢滴加4 mol·L-1的NaOH溶液,产生沉淀的物质的量(mol)与加入NaOH溶液的体积(ml)的关系如图2所示:
①1写出DE段发生反应的离子方程式:_____________________________________________。
②B与A的差值为_______________________________________________________________。
【答案】 2Al+Fe2O3![]() Al2O3+2Fe 取少量固体样品加入NaOH溶液中 若有(无)气泡产生,说明该样品中含有(不含)铝 取少量样品加入稀硫酸中,滴加KSCN溶液 若溶液变红色,说明原样品中含有Fe2O3,反之则不含Fe2O3 NH4++OH-=NH3·H2O 0.008
Al2O3+2Fe 取少量固体样品加入NaOH溶液中 若有(无)气泡产生,说明该样品中含有(不含)铝 取少量样品加入稀硫酸中,滴加KSCN溶液 若溶液变红色,说明原样品中含有Fe2O3,反之则不含Fe2O3 NH4++OH-=NH3·H2O 0.008
【解析】(1)铝粉和氧化铁在高温下反应生成氧化铝和铁,反应的离子方程式为2Al+Fe2O3![]() Al2O3+2Fe;(2)铝和与氢氧化钠反应,可取少量固体样品加入NaOH溶液中,若有气泡产生,说明该样品中含有铝,否则没有铝;检验氧化铁,可取少量样品加入稀硫酸中,滴加KSCN溶液,若溶液变红色,说明原样品中含有Fe2O3,反之,则不含Fe2O3,故答案为:
Al2O3+2Fe;(2)铝和与氢氧化钠反应,可取少量固体样品加入NaOH溶液中,若有气泡产生,说明该样品中含有铝,否则没有铝;检验氧化铁,可取少量样品加入稀硫酸中,滴加KSCN溶液,若溶液变红色,说明原样品中含有Fe2O3,反之,则不含Fe2O3,故答案为:
检验成分 | 操作步骤 | 实验现象与结论 |
铝 | 取少量固体样品加入NaOH溶液中 | 若有(无)气泡产生,说明该样品中含有(不含)铝 |
氧化铁 | 取少量样品加入稀硫酸中,滴加KSCN溶液 | 若溶液变红色,说明原样品中含有Fe2O3,反之,则不含Fe2O3 |
(3)①OC发生H++OH-═H2O;CD反应生成氢氧化铝和氢氧化铁沉淀,D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,离子方程式为,NH4++OH-═NH3H2O;②E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol,Al(OH)3+NaOH=NaAlO2+2H2O
1 mol 1mol
0.008 mol 0.008mol
Al(OH)3的量是0.008mol,所以Al3+也是0.008mol。所以B与A差值为0.008mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ:乙烯产量是衡量一个国家石油化工水平的主要标志。下图是由乙烯合成乙酸乙酯可能的合成路线:
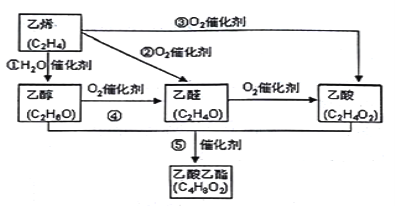
请回答下列问题:
(1)反应④的化学方程式为_____________________________ ;
(2)在实验室制备乙酸乙酯时,用到饱和的碳酸钠溶液,其作用是:___________________;
(3)乙醇的结构式为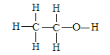 ,若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为 _________________________________;
,若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为 _________________________________;
Ⅱ:酸奶中含有乳酸,乳酸在常温常压下是一种无色的粘度很大的液体。取9.0g乳酸与足量的Na反应,在标准状况下可收集到2.24L气体;另取9.0g乳酸与足量的NaHCO3溶液反应,生成的CO2气体在标准状况下体积为2.24L。已知乳酸分子中含有一个甲基,请回答下列问题:
(1)乳酸的相对分子质量为:_______________________;
(2)在浓硫酸存在的条件下,两分子乳酸相互反应生成环状酯类化合物,请写出该反应的化学反应方程式:________________________,其反应类型为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,一种烷烃A和一种单烯烃B组成混合气体,A 或B 分子均最多只含有4 个碳原子,且B 分子的碳原子数比A 分子的多。将1升该混合气体充分燃烧,在同温同压下得到2.5升CO2气体。120℃时取1 升该混合气体与9 升氧气混和,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%。则A 和B 的分子式分别为( )
A. C2H6、C4H8 B. C2H6、C3H6
C. CH4、C4H8 D. CH4、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
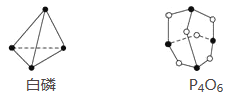
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H2 ![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可___(填“吸收”或“放出”)热量___kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是_______________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为_____mol/(L·min)。
(4)一定条件下,当合成氨反应达到化学平衡时,下列说法正确的是________
A.正反应速率和逆反应速率相等 B.正反应速率最大,逆反应速率为0
C.N2的转化率达到最大值 D.N2和H2的浓度相等
E.N2、H2和NH3的体积分数相等 F.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图的装置制备乙酸乙酯。
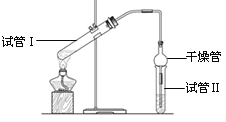
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:_____________。
(2)请写出用CH3CH218OH制备乙酸乙酯的化学方程式:_____________,反应类型为_______。
(3)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验 编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中的试剂 | 有机层的厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
②分析实验_________________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(4)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________(用百分数表示,保留一位小数)。
II、已知乳酸的结构简式为![]() 。试回答:
。试回答:
①乳酸分子中的官能团有:_____________________________________(写名称);
②乳酸与足量金属钠反应的化学方程式为________________________________;
③已知—COOH不会发生催化氧化,写出加热时,乳酸在Cu作用下与O2反应的化学方程式:________________________________________________;
④腈纶织物产泛地用作衣物、床上用品等。腈纶是由CH2=CH-CN聚合而成的。 写出在催化剂、加热条件下制备腈纶的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%,其余为氧。
(1)X的分子式是________。
(2)X能与金属钠反应放出氢气,则X结构中含有的官能团的名称为________。
(3)X与空气中的氧气在催化剂作用下反应生成了Y,该反应的化学方程式是_________,反应类型为________。
(4)X与高锰酸钾酸性溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应生成132 g W,该反应的化学方程式为_________,其中X的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃的锌锰干电池对环境污染很大,工业上可用如下工艺回收正极材料中的金属(部分条件未给出):
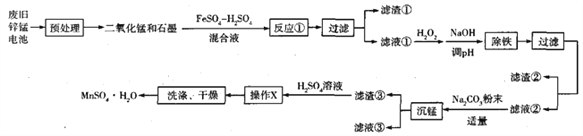
(1)废弃的锌锰干电池对环境的主要危害是__________, ![]() 中
中![]() 的化合价为__________。
的化合价为__________。
(2)锌锰干电池中氯化铵为电解质,其电子式为______________________________。
(3)反应①中氧化剂与还原剂的物质的量之比为______________________________。
(4)该工艺流程中多次用到过滤,实验室中过滤所需要的玻璃仪器有__________。
(5)已知:25℃时, ![]() ,滤液①中加入NaOH溶液至pH=_________时,
,滤液①中加入NaOH溶液至pH=_________时, ![]() 沉淀完全
沉淀完全![]() 时,认为
时,认为![]() 沉淀完全]。
沉淀完全]。
(6)写出“沉锰”过程中生成碱式碳酸锰![]() 的离子方程式为:______________________________________________________________________。
的离子方程式为:______________________________________________________________________。
(7)用硫酸酸化的![]() 浆液可吸收工业废气中的
浆液可吸收工业废气中的![]() 生成
生成![]() ,已知浆液中
,已知浆液中![]() 含量为
含量为![]() ,工业废气中
,工业废气中![]() 含量为
含量为![]() ,
, ![]() 的吸收率可达90%,则处理1000
的吸收率可达90%,则处理1000![]() 工业尾气,可得到
工业尾气,可得到![]() 的质量为__________kg(用含字母的代数式表示)。
的质量为__________kg(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_______________________________________。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为_____________________。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______________mol·L-1(填精确计算结果)。
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com