
| A. | 根据金属失去电子的多少来判断,失去电子较多的金属性较强 | |
| B. | 用钠置换MgCl2溶液中的Mg2+,来验证钠的金属性强于Mg | |
| C. | Mg不与NaOH溶液反应而Al能与NaOH溶液反应,可说明金属性:Al>Mg | |
| D. | 碱性:NaOH>Mg(OH)2>Al(OH)3,可说明钠、镁、铝金属性依次减弱 |
分析 A、金属性强弱取决于失去电子的难易程度,失去电子越容易金属性越强,失去电子越难金属性越弱,与失去电子数目无关;
B、Na与MgCl2溶液反应生成氢氧化镁和氢气;
C、比较金属金属性可以与稀非氧化性酸反应置换出氢气来比较,而不能用与碱反应来比较;
D、最高价氧化物对应水化物的碱性越强,则对应元素的非金属性越强.
解答 解:A、金属性强弱取决于失去电子的难易程度,失去电子越容易金属性越强,失去电子越难金属性越弱,与失去电子数目无关,例如钠和铝,钠失去1个电子生成钠离子,铝失去3个电子生成铝离子,但是钠的金属性强于铝,故A错误;
B、Na易于水反应生成氢氧化钠和氢气,钠与MgCl2溶液反应生成氢氧化镁和氢气,故B错误;
C、比较金属金属性可以与稀非氧化性酸反应置换出氢气来比较,而不能用与碱反应来比较,故C错误;
D、最高价氧化物对应水化物的碱性越强,则对应元素的非金属性越强,因为碱性:NaOH>Mg(OH)2>Al(OH)3,可说明钠、镁、铝金属性依次减弱,故D正确;
故选D.
点评 本题考查金属性强弱的比较,题目难度不大,注意把握比较的角度,结合常见物质的性质解答,易错点为C、D.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题
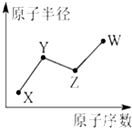 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随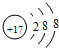 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
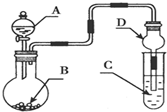
| A. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| B. | 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色 | |
| C. | 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 | |
| D. | 若A为浓H2SO4,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
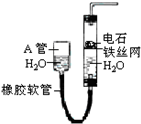 如图中的实验装置,可用于制取乙炔,请填写下列空白:
如图中的实验装置,可用于制取乙炔,请填写下列空白: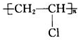 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22-存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22-存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )| A. | 1 个 Ca2+周围距离最近且等距离的 C22-数目为 6 | |
| B. | 该晶体中的阴离子与F2是等电子体 | |
| C. | 6.4 g CaC2晶体中含阴离子0.1 mol | |
| D. | 与每个Ca2+距离相等且最近的Ca2+共有12个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com