
【题目】在0.5L某刚性密闭容器中,充入2molCO和1molNO2,在一定条件下发生反应:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)。2min时该反应达到平衡,反应前后容器内压强比为12:11。下列判断错误的是( )
4CO2(g)+N2(g)。2min时该反应达到平衡,反应前后容器内压强比为12:11。下列判断错误的是( )
A.N2的平衡浓度为0.5mol·L-1
B.2min内NO2的平均反应速率为0.25mol·L-1·min-1
C.反应任意时刻CO和NO2的转化率均相等
D.平衡后再向容器中充入2molCO和1molNO2,再次平衡后,CO的转化率大于50%
【答案】B
【解析】
相同条件下,气体的压强之比等于物质的量之比,设平衡时转化CO的物质的量为xmol,则列三段式有:
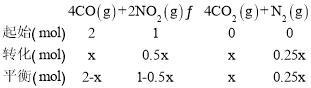
则![]() ,解得x=1mol。
,解得x=1mol。
A.N2的平衡浓度为![]() ,故A正确;
,故A正确;
B.2min内NO2的平均反应速率为![]() =0.5molL-1min-1,故B错误;
=0.5molL-1min-1,故B错误;
C.充入2mol CO和1mol NO2,且按2:1反应,则反应任意时刻CO和NO2的转化率均相等,故C正确;
D.平衡时,CO的转化率为![]() ×100%=50%,平衡后再向容器中充入2mol CO和1mol NO2,若达到等效平衡则转化率不变,但该反应中反应物气体系数之和大于生成物气体系数之和,相当于增大压强,平衡正向移动,则CO的转化率大于50%,故D正确。
×100%=50%,平衡后再向容器中充入2mol CO和1mol NO2,若达到等效平衡则转化率不变,但该反应中反应物气体系数之和大于生成物气体系数之和,相当于增大压强,平衡正向移动,则CO的转化率大于50%,故D正确。
故选:B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有关晶体的结构如下图所示,下列说法中正确的是( )
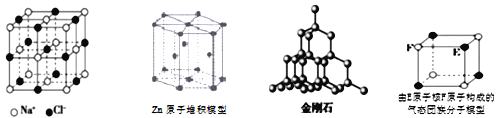
A.在NaCl晶体中,距Na+离子最近且等距的Na+离子有6个
B.金属Zn中Zn原子堆积模型如图所示,空间利用率为68%
C.在金刚石晶体中,碳原子与碳碳键(C—C)数目之比为1:2
D.该气态闭簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与足量的NaOH溶液共热后,再通入CO2
B.溶液加热,通入足量的HCl
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,该有机物能发生( )
,该有机物能发生( )
①取代反应,②加成反应,③消去反应,④使溴水褪色,⑤使酸性KMnO4溶液褪色,⑥与AgNO3溶液生成白色沉淀,⑦聚合反应
A.以上反应均可发生B.只有⑦不能发生
C.只有⑥不能发生D.只有②不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有Cu、Fe、Al、Co、Li、Si等成分的某合金废料回收利用的工艺流程如图所示。

已知:
①Fe、Co在周期表中属同周期、同族;常温下,pH=7.3时Li+或Co3+开始沉淀。
②有关物质的溶度积(Ksp):
物质 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Ksp | 4.0×10-21mol3·L-3 | 1.0×10-32mol4·L-4 | 1.0×10-38mol4·L-4 | 8.0×10-19mol3·L-3 |
回答下列问题
(1)Na2CO3溶液可作为合金废料的油污除剂,用离子方程式表示其原理__。
(2)“浸出渣”中的物质为__。
(3)①“浸出液”加入双氧水的作用是__(用离子方程式表示)。
②氨水的作用是调节溶液的pH,常温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1认为完全沉淀)。需调节溶液的pH范围为__。
(4)得到的CoC2O4·2H2O晶体在空气中充分焙烧可得Co2O3,化学方程式为__。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度的关系如表所示。
温度/℃ | 10 | 30 | 60 |
浓度/(mol·L-1) | 0.21 | 0.17 | 0.14 |
则操作X为蒸发浓缩、__,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺—1,2—二甲基环丙烷和反—1,2—二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)分别称作正、逆反应速率常数,它们受温度和催化剂影响。下列有关说法正确的是( )
A.某温度时,该反应的平衡常数可表示为K=![]()
B.正、逆反应速率常数改变,平衡常数也一定会随之改变
C.若升高温度,平衡逆向移动,则说明正反应的活化能高于逆反应的活化能
D.催化剂可以改变反应速率但不影响平衡,说明催化剂同等程度改变k(正)和k(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。
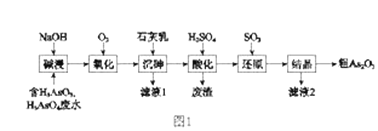
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
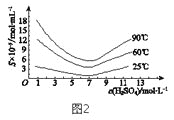
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴酚酞做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____________________。滴定终点的现象是_________________________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是___________ (填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为_____mL。
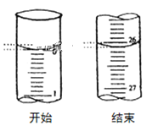
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液去除油污 | 纯碱与油污直接发生反应,生成易溶于水的物质 |
B | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
C | 漂白粉在空气中久置变质 | 漂白粉中的ClO-可以水解成HClO |
D | FeCl3溶液可用于水处理 | FeCl3中Fe3+具有氧化性可杀菌消毒 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com