
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
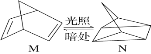
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH=+88.6 kJ·mol-1, 则M与N较稳定的是_________。
(2)已知CH3OH(l)的燃烧热为726.5 kJ·mol-1,CH3OH(l) +1/2 O2(g)===CO2(g)+2H2O(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时放出145 kJ热量,写出该反应的热化学方程式:_____________________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 __________ 。
(5)已知拆开1 mol H-H键、1 mol N-H键、1 mol N≡N 键分别需要的能量是a kJ、b kJ、c kJ,则N2与H2反应生成NH3的热化学方程式为 _________________________________ 。
(6)通过以下反应可获得新型能源二甲醚(CH3OCH3)。
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1
则反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=__________________________________ 。(用含a,b,c,d的式子表示)
【答案】M < 2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH =-290 kJ·mol-1 98 kJ N2(g)+3H2(g)===2NH3(g) ΔH = (3a+c-6b) kJ·mol-1 (2b+2c+d) kJ·mol-1
【解析】
根据键能计算反应热,根据热化学方程式的书写规则书写热方程式,并运用盖斯定律计算反应热。
(1)ΔH![]() ,为吸热反应,能量越低越稳定,则M与N相比较稳定的是M;
,为吸热反应,能量越低越稳定,则M与N相比较稳定的是M;
(2)H2O(g)![]() H2O(l)过程中放热,则a<726.5;
H2O(l)过程中放热,则a<726.5;
(3)根据热化学方程式的书写规则,此热化学方程式为:2Cl2(g)+2H2O(g)+C(s)==4HCl(g)+CO2(g) ΔH =-290 kJ·mol-1;
(4)由热化学方程式4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1得,4mol铝反应放出1176 kJ热量,反应中铝化合价由0升高到+3,失去12mol电子,所以每转移1 mol电子放出的热量为1176 kJ/12=98 kJ;
(5)在反应N2+3H22NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:(3a+c)kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×bkJ,该反应吸收的热量为:(3a+c-6b) kJ;
故答案为:N2(g)+3H2(g)===2NH3(g) ΔH = (3a+c-6b) kJ·mol-1;
(6)结合盖斯定律,找出反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)可以由2×②+2×③+④得到,则ΔH=(2b+2c+d) kJ·mol-1。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于过滤和蒸发说法中不正确的是( )
A. 过滤常用来分离液体与固体混合物
B. 若使溶液中的溶质析出只能选用加热蒸发的方法
C. 过滤实验用到的仪器有烧杯、漏斗、玻璃棒、铁架台等
D. 蒸发实验用到的仪器有酒精灯、蒸发皿、玻璃棒、铁架台等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的物质的量浓度为c mol·L-1,密度为ρg·mL-1,质量分数为ω,则下列关系中不正确的是( )
A. ρ=![]() B. ω=17c/1000ρ
B. ω=17c/1000ρ
C. ω=17V/(17V +22400) D. C =1000Vρ/(17V + 22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
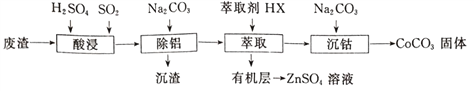
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X、Y、Z为甲苯的同分异构体,Z的空间结构类似于篮子。下列说法正确的是( )
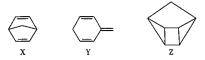
A. Z的一氯代物只有3种B. 甲苯的同分异构体只有X、Y、Z
C. X分子中所有碳原子一定在同一平面D. 1molY发生加成反应最多消耗4molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、X、W、D、E为短周期元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物可使湿润的红色石蕊试纸变蓝, A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为______________________。W的原子结构示意图为________。
(2)A、X 两种元素能形成含18电子的分子,请写出该分子的电子式:_______________。
用电子式表示化合物D2W的形成过程______________________________________。
(3)下列事实能说明W元素的非金属性比S元素的非金属性强的是________ (填字母)。
a.W单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol W单质比1 mol S得电子多
c.W和S两元素的简单氢化物受热分解,前者的分解温度高
(4)实验室制备A和X形成的气态化合物的化学方程式为____________________________。
(5)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式_________________________________________________________________________。
(6)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A的结构简式如图:
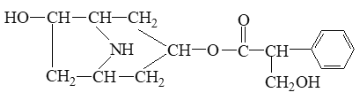
(1)A分子式是______________。
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香化合物。B和C的结构简式是B:______________,C:_____________。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是_________________。
(4)写出同时符合下列两项要求的E的所有同分异构体的结构简式_____。
①化合物是1,3,5—三取代苯
②苯环上的三个取代基分别为甲基.羟基和含有-COO-结构的基团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素(以I形式存在)。实验室中提取碘的流程如下:

(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78 ℃) B.四氯化碳(沸点77 ℃)
C.甘油(沸点290 ℃) D.苯(沸点80 ℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量________(填序号)溶液,反应的离子方程式___________________。
A.KIO3 B.HClO C.KI D.Br2
(4)利用碘的有机溶液得到单质I2的方法是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com