
 CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表: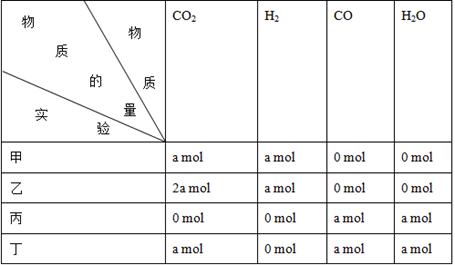
| A.乙=丁>丙=甲 | B.乙>丁>甲>丙 |
| C.丁>乙>丙=甲 | D.丁>丙>乙>甲 |
 CO(g)+H2O(g)
CO(g)+H2O(g)

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:不详 题型:单选题
 I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )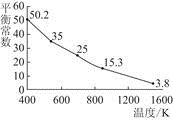
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是( )
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是( )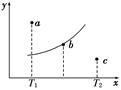
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是| A.①②③④ | B.②⑥⑨ | C.②⑥⑨⑩ | D.③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 和
和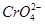 ,常用的方法有两种。
,常用的方法有两种。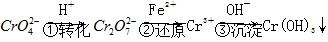 。
。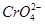 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O。
(橙色)+H2O。 ,需要________mol的FeSO4·7H2O。
,需要________mol的FeSO4·7H2O。 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。 的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 PCl3(g)+Cl2(g) ①
PCl3(g)+Cl2(g) ① H2(g)+I2(g) ②
H2(g)+I2(g) ② N2O4(g) ③
N2O4(g) ③| A.均不变 |
| B.均增大 |
| C.①增大,②不变,③减少 |
| D.①减少,②不变,③增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | X | Y | Z |
| 初始物质的量(mol) | 0.2 | 0.2 | 0 |
| 平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
 2Z,其平衡常数为8 000
2Z,其平衡常数为8 000查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
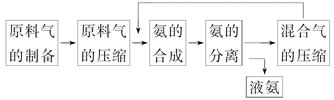
| A.混合气进行循环利用遵循绿色化学思想 |
| B.合成氨反应须在低温下进行 |
| C.对原料气进行压缩是为了增大原料气的转化率 |
| D.使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com