
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1mol Cu2S,有4 mol硫被氧化 | |
| D. | 每转移1.2 mol电子,有0.3 mol硫被氧化 |
分析 2CuFeS2+O2→Cu2S+2FeS+SO2中,Cu元素的化合价由+2价降低为+1价,O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,以此来解答.
解答 解:A.O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,则SO2既是氧化产物又是还原产物,故A正确;
B.Cu元素的化合价降低,S元素的化合价升高,则CuFeS2既作氧化剂又作还原剂,S元素被氧化,故B错误;
C.由反应可知,生成1 molCu2S,有1mol硫被氧化,故C错误;
D.由反应可知,1molS被氧化转移6mol电子,则每转移1.2 mol电子,有0.2mol硫被氧化,故D错误;
故选A.
点评 本题考查氧化还原反应,注意把握元素的化合价及反应中的变化为解答的关键,侧重基本概念的考查,题目难度不大.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:解答题
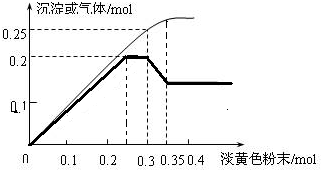 图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:
图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
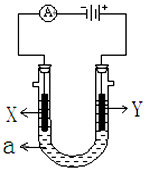 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现象相同,沉淀量相等 | B. | 现象不同,沉淀量不等 | ||
| C. | 现象相同,沉淀量不等 | D. | 现象不同,沉淀量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用排饱和食盐水的方法收集氯气 | |
| B. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| C. | 打开汽水瓶,看到有大量的气泡逸出 | |
| D. | Fe(SCN)3溶液中加入6mol/LNaOH溶液后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤③②⑥ | B. | ④①③⑤②⑥ | C. | ⑤④③①②⑥ | D. | ③④⑤①②⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com