

 或
或 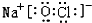 .
.分析 由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等;
(4)表中两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应;
(5)向X中滴加Y,先有白色沉淀Z生成,继续滴加沉淀消失,应是铝盐与氢氧化钠反应或是偏铝酸盐与酸反应,则Z为Al(OH)3,M为Al2O3,实验室常用铝盐与氨水制备氢氧化铝,电解熔融的氧化铝得到Al.
解答 解:由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:故原子半径:Na>Al>O,故答案为:Na>Al>O;
(2)非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,故答案为:HNO3>H2CO3>H2SiO3 ;
(3)①、④、⑤、⑧中的某些元素可形成NaOH、NaClO等离子化合物,电子式分别为、 、
、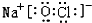 ,
,
故答案为: 或
或 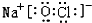 ;
;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:ab;
(5)向X中滴加Y,先有白色沉淀Z生成,继续滴加沉淀消失,应是铝盐与氢氧化钠反应或是偏铝酸盐与酸反应,则Z为Al(OH)3,M为Al2O3,
沉淀消失的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O或Al(OH)3+3H+=Al3++3H2O;
实验室常用铝盐与氨水制备氢氧化铝,离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
M→N反应的化学方程式为:2Al2O3(熔融)$\frac{\underline{\;\;\;\;\;△\;\;\;\;\;}}{冰晶石}$4Al+3O2↑,
故答案为:Al(OH)3+OH-=AlO2-+2H2O或Al(OH)3+3H+=Al3++3H2O;Al3++3NH3.H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融)$\frac{\underline{\;\;\;\;\;△\;\;\;\;\;}}{冰晶石}$4Al+3O2↑.
点评 本题考查元素周期表与元素周期律、无机物推断等,难度中等,注意整体把握元素周期表的结构,熟练掌握元素周期律的递变规律.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液的SO42- | |
| D. | 先后添加酚酞试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3(浓)═Fe(NO3)3+3NO2↑+3H2O | |
| B. | 向氯化铵的稀溶液中加入少量NaOH:NH4++OH-═NH3↑+H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素原子最外层电子数越少,该金属失电子能力越强 | |
| B. | 若存在简单阴离子R2-,则R一定位于ⅥA族 | |
| C. | aA2+、bB+、cC3-三种离子具有相同的电子层结构,则原子序数c>a>b | |
| D. | 铅位于周期表中金属和非金属的交界处,可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二种 | B. | 三种 | C. | 四种 | D. | 五种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷一种无色无味的气体 | B. | 甲烷性质稳定,不和其它物质反应 | ||
| C. | 甲烷极难溶解于水 | D. | 甲烷密度比空气的密度小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe2+、NO3-、ClO- | B. | Al3+、Mg2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HSO3- | D. | Na+、K+、NO3-、SiO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com