
����Ŀ��Fe2O3��Cu2O�Ǻ�ɫ��ĩ���������ϡ�ijУ��ѧʵ��С��ͨ��ʵ����̽����ɫ��ĩ�ijɷ���Fe2O3��Cu2O����ߵĻ���̽���������£�
��������֪��Cu2O����ϡ��������Cu��CuSO4���ڿ����м�������CuO��
������裺����1����ɫ��ĩ��Fe2O3������2����ɫ��ĩ��Cu2O������3����ɫ��ĩ��Fe2O3��Cu2O�Ļ����
���ʵ�飺ȡ������ĩ��������ϡ�����У���������Һ���ٵμ�KSCN��Һ��
(1)������1��������ʵ��������____��������2������������Ӧ�����ӷ���ʽΪ______��
(2)��ʵ�������ȷ����ɫ��ĩΪFe2O3��Cu2O�Ļ������ʵ�������ߵ����ʵ�����ȡһ�����ĸù����ĩ����500 mLδ֪Ũ�ȵ�ϡ������Һ�У�����ȫ���ܽ⣬��Ӧ�����Һ�м���Fe�ۣ���Һ�в������ӵ����ʵ�����Fe�ۼ��룬�仯��ͼ��ʾ����Fe2O3��Cu2O�����ʵ����ֱ�Ϊ____�� _______��

(3)������Һ�����ʵ���Ũ����____��
���𰸡�����ȫ�ܣ���Һ��Ϊ�ػ�ɫ�������Һ��ΪѪ��ɫ Cu2O+2H+=Cu+Cu2++H2O 0.15mol 0.1mol 1.4mol/L
��������
(1)Fe3+����KSCN��Һ�ʺ�ɫ��Cu2O����������Cu������ͭ����Fe3+������ҺҲ����죻
(2)��ɫ��ĩΪFe2O3��Cu2O�Ļ�������ϡ�������ȫ���ܽ⣬��Һ��ʣ���������Ӻ�ͭ���ӣ������ӣ����������ʺ����������ʵ�����С������ͼ�����������ӵ����ʵ�����
(1)������1������Fe2O3��ϡ���ᷴӦ����Fe3+����ʵ������Ϊ�����ܽ⣬��Һ��Ϊ�ػ�ɫ������KSCN��Һ�ʺ�ɫ��
������֪Cu2O����ϡ��������Cu��CuSO4��ͭΪ��ɫ���岻��ˮ��ͭ���ӵ���ɫΪ��ɫ������Һ����������Һ����Fe3+�����Եμ�KSCN�Լ�Ҳ����죬���ӷ���ʽCu2O+2H+=Cu+Cu2++H2O��
(2)���������ӷ���ʽΪFe2O3+6H+=2Fe3++3H2O��Cu2O+2H+=Cu+Cu2++H2O��������Һ��û�й��壬�������ӷ�ӦCu+2Fe3+= Cu2++ 2Fe2+����Һ��ʣ��Cu2+��H+�����ܺ���Fe3+������ͼ�������������ʵ�����С��0������Һ��һ������Fe3+��������֮ǰ�����ķ�Ӧ Fe2O3+6H+=2Fe3++3H2O��Cu2O+2H+=Cu+Cu2++H2O��Cu+2Fe3+= Cu2++ 2Fe2+������������Fe3+��Cu2+��H+��������֮�����ķ�ӦΪ2Fe3++ Fe= 3Fe2+��Cu2+ +Fe= Cu+ Fe2+��Fe+ 2H+= Fe2++H2����
��Fe2O3�����ʵ���Ϊx��Cu2O�����ʵ���Ϊy��
![]()
![]()
![]()
![]()
![]()
![]()
�������������ӵ����ʵ�����ϵ������ϵʽ 2x-2y=0.1��
����ͭ���ӹ�ϵʽ������ y+y=0.2 ���y=0.1mol��x=0.15mol��
(3)��ͼ���֪��������0.4mol����ʱ����Һǡ��ΪFeSO4��Һ��������Ԫ���غ㣬����FeSO4�����ʵ���Ϊ0.4mol+0.15mol��2=0.7mol���ٸ�����Ԫ���غ㣬n(H2SO4)=n(FeSO4)=0.7mol������c(����)=![]() =
=![]() =1.4mol/L��
=1.4mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�������
A.����ϵͳ�������������� ������Ϊ2��3��������3���һ�����
������Ϊ2��3��������3���һ�����
B.�����ס����ȵ����ʿ�����ˮ������Щ��������Һ�м��루NH4��2SO4��Na2SO4��Ũ��Һ����ʹ�����ʵ��ܽ�Ƚ��Ͷ�����
C.![]() �ɷ����ӳɷ�Ӧ��ȡ����Ӧ��������Ӧ
�ɷ����ӳɷ�Ӧ��ȡ����Ӧ��������Ӧ
D.�л���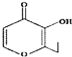 ���׳���һ����������һ�ֺ�������ͬ���칹���ܷ���������Ӧ
���׳���һ����������һ�ֺ�������ͬ���칹���ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����������з�һС���ƣ��������ۻ�ʱ���ò�����պȡ������ˮCuSO4���ۻ����ƽӴ���˲�����ҫ�۵Ļ�ͬʱ�к�ɫ�������ɣ��ݴ��жϣ�����˵����ȷ����

A.������Ӧ����˵���Ʊ�ͭ����
B.������Ӧ������ֻ��һ��������ԭ��Ӧ����
C.��������ˮ�����£�Na������CuSO4��Ӧ������Cu
D.����������Ӧ��˵���ƿ��Դ�����ͭ����Һ���û���ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼�����������Բ��ϣ�˫��A�;�̼�����ĺϳ�·�����£�

(1)B�Ļ�ѧ����Ϊ________��B�еĹ����ŵ�������________��
(2)��Ӧ�۵ķ�Ӧ������________��
(3)д��D��E�ķ�Ӧ����ʽ________��
(4)д����Ӧ���г�����˫��A�;�̼������IJ���Ľṹ��ʽ________��
(5)д����������������F��ͬ���칹��Ľṹ��ʽ________(�����������칹��ֻ��д��2��)��
���ܷ���������Ӧ ����FeCl3��Һ����ɫ �ۺ˴Ź��������������
(6)�����1-�����Ʊ�![]() �ĺϳ�·��________�����Լ���ѡ����
�ĺϳ�·��________�����Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Z��Q��ԭ����������������֪A��B��C��D�������е����ֻ�����Ԫ�ؼ��γɵĻ����YԪ�ص���ɫ��Ӧ�ʻ�ɫ��Y��Z��Q������������Ӧˮ�����֮��ɷ�Ӧ��B�������������D����W��Q�γɵĻ���������£�![]() ��Һ��pHΪ1����һ������������֮����ת����ϵ��ͼ��ʾ������˵����ȷ����
��Һ��pHΪ1����һ������������֮����ת����ϵ��ͼ��ʾ������˵����ȷ����
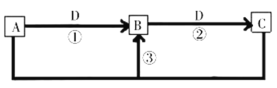
A.��ͨ��������ڵ�C�õ�Z����
B.XԪ�ص��⻯��е��ͬ����Ԫ�ص��⻯���
C.W��X��Y��ZԪ�ص�ԭ�Ӱ뾶��СΪ![]()
D.A��ˮ��Һ�������ԣ�����Ϊ����Ԫ��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦmA(g)+ nB![]() pC(g)+qD(g)�У�A��D������ɫ���壬�ﵽƽ�������������ȷ���ǣ� ��
pC(g)+qD(g)�У�A��D������ɫ���壬�ﵽƽ�������������ȷ���ǣ� ��
A.������B������ƽ����ϵ��ɫ���˵��B��������
B.����ѹǿ��ƽ�ⲻ�ƶ���˵��m+nһ������p+q
C.�����¶ȣ�A��ת���ʼ�С��˵������Ӧ�����ȷ�Ӧ
D.��B�����壬����A������A��B��ת���ʶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���1.0mol CO��1.0mol H2O��ϼ��ȵ�800�棬�������з�Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol��������˵����ȷ���ǣ� ��
CO2��g��+H2��g����һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol��������˵����ȷ���ǣ� ��
A.800���£��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ0.25
B.427��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ9.4����÷�Ӧ�ġ�H��0
C.800���£����������ƽ����ϵ��ͨ��1.0mol��CO��g������ƽ��ʱCO���ʵ�������Ϊ33.3%
D.800���£����������ƽ����ϵ��ͨ��1.0mol��H2O��g������ƽ��ʱCOת����Ϊ33.3%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����N2O��CO��Fe+�����·�����Ӧ�������仯����Ӧ��������ͼ��ʾ,����˵���������
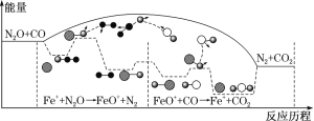
A. ��Ӧ�ܹ�����H<0
B. Fe+ʹ��Ӧ�Ļ�ܼ�С
C. FeO+Ҳ�Ǹ÷�Ӧ�Ĵ���
D. Fe++N2O![]() FeO++N2��FeO++CO
FeO++N2��FeO++CO![]() Fe++CO2������Ӧ��Ϊ���ȷ�Ӧ
Fe++CO2������Ӧ��Ϊ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ʒ�������п�����������ҪĿ�����ڱ�������һ�����ܵ�Fe3O4��Ϊ���о�������Ƭ����һ����������Ƭ�ӹ��ɾ��ȷ�ĩ��ȡmg�÷�ĩ������28.00 mL 1.000mol��L��1�������У�ǡ����ȫ��Ӧ������134.4 mL���壨��״��������Ӧ�����Һ�е���KSCN��Һ������������
(1)����mg��Ʒ��n(Fe3O4)=______mol��
(2)�������������_______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com