
 磷单质及其化合物有广泛应用.
磷单质及其化合物有广泛应用.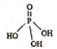 )之间脱去两个水分子的产物,其结构简式为
)之间脱去两个水分子的产物,其结构简式为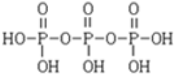 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.分析 (1)碳酸钙与硫酸反应生成磷酸二氢钙和二氧化碳和水;依据方程式计算生成硫酸二氢钙的质量;
(2)依据副渣成分判断解答;
(3)相邻的磷酸分子中1个去掉羟基,一个去掉氢原子即可形成三聚磷酸;三聚磷酸与5分子氢氧化钠反应生成三聚磷酸钠;
(4)根据氧化还原反应中化合价变化及质量守恒定律判断反应物和生成物,并配平反应方程式;
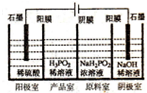
(5)①根据阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,判断放电能力强弱,然后写出阳极的电极反应式;
②根据图示“四室电渗析法”工作原理分析产品室可得到H3PO2的原因.
解答 解:(1)碳酸钙与硫酸反应生成磷酸二氢钙和二氧化碳和水,方程式为:CaCO3+2H3PO4=Ca(H2PO4)2+H2O+CO2↑,
设生成磷酸二氢钙的质量为m,依据方程式:
CaCO3+2H3PO4=Ca(H2PO4)2+H2O+CO2↑,
100 234
1×103kg m
解得m=2.34×103kg;
故答案为:CaCO3+2H3PO4=Ca(H2PO4)2+H2O+CO2↑;2.34×103;
(2)用石英、焦炭与磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的化学方程式为:4Ca5(PO4)3F+21SiO2+30C=3P4+20CaSiO3+30CO↑+SiF4↑:在此反应中,副产物矿渣含有硅酸钙,硅酸钙为制备水泥的主要原料,
故答案为:制水泥;
(3)相邻的磷酸分子中1个去掉羟基,一个去掉氢原子即可形成三聚磷酸,结构简式为 ;三聚磷酸与5分子氢氧化钠反应生成三聚磷酸钠化学式为:Na5P3O10;
;三聚磷酸与5分子氢氧化钠反应生成三聚磷酸钠化学式为:Na5P3O10;
故答案为: ;Na5P3O10;
;Na5P3O10;
(4)由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:H2O+Ni2++H2PO2-═Ni+H2PO3-+2H+,镍离子被还原成金属Ni,还原产物为Ni,
故答案为:1;1;H2O;1;1;2H+;
(5)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:4OH--4e-=O2↑+2H2O;
故答案为:4OH--4e-=O2↑+2H2O;
②产品室可得到H3PO2的原因是:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2,
故答案为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2.
点评 本题为综合题,考查了化学方程式的书写、氧化还原反应方程式配平、电极反应书写,明确电解池工作原理,准确判断离子放电顺序是解题关键,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,22.4L己烷中共价键数目为19NA | |
| C. | 通常状况下,2.24LNO2和N2O4的混合气体中氮原子和氧原子数比为1:2 | |
| D. | 1mol•L-1的Na2CO3溶液中所含阴离子数大于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
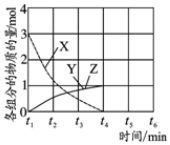
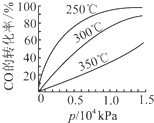 强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.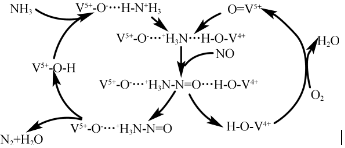
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
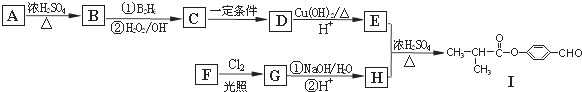
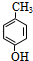 .
. .E与H反应生成I的方程式为
.E与H反应生成I的方程式为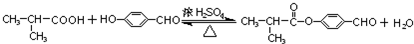 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 向溶液中滴加少量氯水,再滴加KSCN溶液 | 溶液变红 | 证明溶液中含有Fe2+ |
| B | 用铜与稀硫酸检验溶液中的 NO3- | 加热后,试管口有红棕色气体产生 | 硝酸根离子在酸性条件下与铜反应生成NO2 |
| C | 将铝箔放在火焰上灼烧 | 熔化物悬挂不下落 | 铝表面生成高熔点氧化铝未熔化 |
| D | 用盐酸标准液滴定未知浓度的Na2CO3溶液 | 分别用甲基橙和酚酞做指示剂时消耗盐酸的体积相等 | 标准液的用量只与待测液的物质的量有关,与指示剂无关 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
| B | 浓硝酸 | Na2CO3 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 浓盐酸 | KMnO4 | FeBr2(足量) | 氧化性:Cl2>Br2 | |
| D | 浓硫酸 | 蔗糖 | 溴水 | 浓硝酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,0.05mol•L1Fe2(SO4)3溶液中含Fe3+数目小于0.1NA | |
| B. | 30g甲醛中含4NA对电子 | |
| C. | 7.8g过氧化钠中含有0.1NA个阴离子 | |
| D. | 标准状况下,22.4L乙烷含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 两溶液体积相同,酸是多元强酸 | |
| B. | 两溶液体积相同,酸是弱酸 | |
| C. | 酸是强酸,且酸溶液的浓度是碱溶液浓度的3倍以上 | |
| D. | 酸是强酸,且酸溶液的体积是碱溶液体积的3倍以上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| B. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+═SO4 2-+S↓+H2O | |
| C. | 10 mL 0.1 mol/L FeI2溶液与标况下0.224L Cl2:Fe2++Cl2=2Cl-+2Fe3+ | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com