
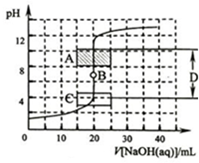
 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.分析 (1)酸碱中和滴定时,滴定开始和滴定终点后的滴定速度可以快一些,接近滴定终点速度要慢,防止滴定过量;
(2)甲基橙、酚酞的变色范围分别是pH在3.1-4.4、8.2-10之间;滴定终点时,溶液的pH为7,注意pH的突变范围;
(3)显碱性的溶液能使酚酞试液变红色,显酸性或显中性的溶液不能使酚酞试液变色;
解答 解:(1)酸碱中和滴定时,滴定开始和滴定终点后的滴定速度可以快一些,接近滴定终点速度要慢,防止滴定过量;
故答案为:滴定终点后;滴定终点;
(2)甲基橙、酚酞的变色范围分别是pH在3.1-4.4、8.2-10之间,A区pH范围使用的指示剂是酚酞,C区pH范围使用的指示剂是甲基橙;滴定终点时,溶液的pH为7,B点是滴定终点;接近滴定终点时,pH会有突变;
故答案为:酚酞;甲基橙;滴定终点;pH突变范围;
(3)在20.0mLA溶液和10.0mLB溶液反应后的混合液中:n(H+)=0.01L×0.100mol•L-1-0.02L×0.01mol•L-1=8×10-4mol;
若取出3.00mL混合溶液,其中的n(H+)′=8×10-5mol;
1滴A溶液中的n(OH-)=0.05×10-3L×0.0100mol•L-1=5×10-7mol;
n(H+)′>n(OH-),所以溶液呈酸性,仍是无色;
故答案为:无色.
点评 本题考查了酸碱中和滴定的实验过程与化学计算,注意指示剂的变色范围,题目难度中等.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H 5OH+3O2═2CO2+3H 2O△H=-29.7 kJ/mol -1 | |
| B. | C2H 5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol -1 | |
| C. | C 2 H 5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol-1 | |
| D. | C2H 5OH(l)+3O2 (g)═2CO 2 (g)+3H 2 O(l)△H=-1366.2kJ/mol -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀硫酸中加硫酸钾溶液 | B. | 将锌粒制成薄锌片 | ||
| C. | 向稀硫酸中加碳酸钠固体 | D. | 向稀硫酸中加硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
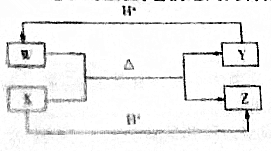
| A. | W的电子式为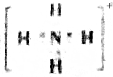 | |
| B. | Y与Z之间可形成氢键 | |
| C. | 硫酸与氢氧化钠溶液反应的离子方程式可表示为X+H+=Z | |
| D. | 微粒Y中各元素原子均达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
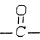 ,则A的可能结构式为
,则A的可能结构式为 、CH3CH2CHO;
、CH3CH2CHO;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原HA溶液中,c(H+)=c(A-) | |
| B. | 当恰好完全中和时,溶液呈中性 | |
| C. | 当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴入少量的NaOH,促进了HA的电离,溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合液中由水电离出的c(H+)=1×10-8mol/L | |
| B. | c(A-)+c(HA)=2c(Na+)=0.4mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与混合液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2c(OH-)-2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
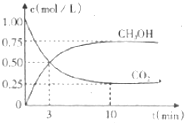 固定和利用C02.能存效地利用资源,并减少空气中的温室气体.工业上正在研究利用C02来生产甲醇燃料的方法,该方法的化学方程式是C02 (g)+3H2 (g)?CH30H (g)+H2O(g)△H=-49.0kJ/mol,在体积为1L的密闭容器中,充人1molCO2和4molH2,一定条件下发生反应:测得C02和CH30H(g)的浓度随时间变化如图所示.下列说法正确的是
固定和利用C02.能存效地利用资源,并减少空气中的温室气体.工业上正在研究利用C02来生产甲醇燃料的方法,该方法的化学方程式是C02 (g)+3H2 (g)?CH30H (g)+H2O(g)△H=-49.0kJ/mol,在体积为1L的密闭容器中,充人1molCO2和4molH2,一定条件下发生反应:测得C02和CH30H(g)的浓度随时间变化如图所示.下列说法正确的是| A. | 该反应在高温条件下能向发进行 | |
| B. | 充人 He(g).能使 $\frac{n(C{H}_{3}OH)}{n(C{0}_{2})}$增大 | |
| C. | 再充入1molCO2和4molH2,能使$\frac{n(C{H}_{2}OH)}{n(C{O}_{2})}$增大 | |
| D. | 容器内气体密度不再改变说明该飞应达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com