
为了控制下述的温度变化,应将温度计的水银球放置在什么适当的位置上.
(1)在蒸馏烧瓶中分馏石油:________.
(2)用酒精和浓硫酸制取乙烯:________.
(3)用苯和混酸混合水浴加热制硝基苯;________.
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
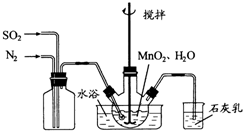 (2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: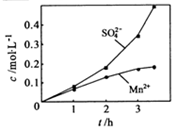
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间t (h) | 1 | 4 | 9 | 16 | 25 |
| MgO膜厚Y (nm) | 0.02a | 0.08a | 0.18a | 0.32a | 0.50a |
| ZnO 膜厚Y (nm) | 1.0×10-3b | 4.0×10-3b | 9.0×10-3b | 1.6×10-2b | 2.5×10-2b |
| NiO 膜厚Y (nm) | 0.3c | 0.6c | 0.9c | 1.2c | 1.5c |
查看答案和解析>>
科目:高中化学 来源:中学教材全解 高中化学 必修 化学与技术 (配山东科学技术出版社实验教科书) 山东科学技术出版社实验教科书 题型:058
(温度计使用题)为了控制下述的温度变化,应将温度计的水银球放置在什么适当的位置上.
(1)在蒸馏烧瓶中分馏石油:________.
(2)用酒精和浓硫酸制取乙烯:________.
(3)用苯和混酸混合水浴加热制硝基苯:________.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
为了控制下述的温度变化,应将温度计的水银球放置在什么适当的位置上.
(1)在蒸馏烧瓶中分馏石油:________.
(2)用酒精和浓硫酸制取乙烯:________.
(3)用苯和混酸混合水浴加热制硝基苯;________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com