
| A、2g | B、4g | C、6g | D、8g |
| 2.8L |
| 22.4L/mol |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
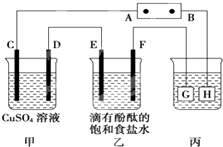 如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有主族元素中,氟的电负性最大 |
| B、钠的第一电离能比镁的第一电离能大 |
| C、第三周期所包含的元素中钠的原子半径最小 |
| D、电子云示意图中的每个小黑点都表示一个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
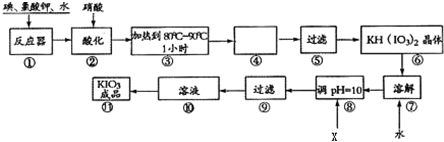
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验①中,石墨棒附近的溶液变红色 |
| B、实验②中,上层固体物质是高级脂肪酸 |
| C、实验③中,黑色的氧化铜被乙醇还原成红色的铜 |
| D、实验④中,所用试液只能是含待测元素的盐溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com