
我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料的研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为____________。
(2)氟、氧、砷三种元素的电负性由大到小的顺序是____________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加入NH4F,发生如下反应:Fe(SCN)3+6NH4F===(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外,还有__________(选填序号)。
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN-中各原子的最外层均满足8电子的稳定结构,则C原子的杂化方式为________,该原子团中σ键与π键的个数比为__________。
(4)FeCl3晶体易溶于水和乙醇,用酒精灯加热即可气化,
而FeF3晶体的熔点高于1000 ℃。试解释这两种化合物熔点差异较大的原因:____________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图K346所示,则Y轴可表示的氢化物(RH3)性质可能有__________。
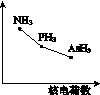
图K346
a.稳定性 b.沸点
c.R—H键能 d.分子间作用力

图K347
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞(结构如图K347所示)顶点的氮原子。据此分析,这种碳氮化钛化合物的化学式为________。
(1)[Ar]3d6 (2)F>O>As (3)①ad ②sp 1∶1
(4)FeF3为离子晶体,FeCl3为分子晶体
(5)①ac ②Ti4CN3
[解析] (1)基态铁原子的核外电子排布为
1s22s22p63s23p63d64s2,基态Fe2+的价电子排布为
1s22s22p63s23p63d6。
(2)自然界中的元素F的电负性最大,O其次。故氟、氧、砷元素的电负性由大到小的顺序为F>O>As。
(3)①(NH4)3FeF6是铵盐,属于离子晶体,故微粒内部含有离子键。NH 中有一个N—H键是配位键,且[FeF6]3-中Fe3+和F-也是靠配位键结合的。②根据SCN-中各原子都满足8电子的稳定结构知其结构式为[S—CN]-,CN三键中C原子需提供2个p轨道形成π键,则其中的C原子采用sp杂化以形成2个单键。由SCN-的结构式[S-CN]-知σ键与π键的个数比为2∶2=1∶1。
中有一个N—H键是配位键,且[FeF6]3-中Fe3+和F-也是靠配位键结合的。②根据SCN-中各原子都满足8电子的稳定结构知其结构式为[S—CN]-,CN三键中C原子需提供2个p轨道形成π键,则其中的C原子采用sp杂化以形成2个单键。由SCN-的结构式[S-CN]-知σ键与π键的个数比为2∶2=1∶1。
(5)①因N、P、As的非金属性逐渐减弱,故NH3、PH3、AsH3的稳定性逐渐减弱、键能逐渐减弱,a、c项正确;氨气分子中因N原子半径小且电负性大,并且含有孤电子对,故氨气分子间存在氢键使其分子间作用力最大,PH3和AsH3因属结构相似的分子晶体,相对分子质量越大,分子间作用力越大,故AsH3的分子间作用力大于PH3,沸点NH3>AsH3>PH3,b、d项错误。
②根据晶胞示意图N(C)= ×8=1,N(Ti)=1+
×8=1,N(Ti)=1+ ×12=4,N(N)=
×12=4,N(N)= ×6=3,则该晶体的化学式为Ti4CN3。
×6=3,则该晶体的化学式为Ti4CN3。


科目:高中化学 来源: 题型:
芳香族化合物A、B、C的分子式均为C8H8O2,苯环上只有一个侧链,其性质如下:
| 物质 性质 | 与NaOH溶液 | 与银氨溶液 | 与钠 |
| A | 水解 | 不产生银镜 | 不反应 |
| B | 中和 | 不产生银镜 | 产生H2 |
| C | 水解 | 产生银镜 | 不反应 |
写出A、B、C的结构简式:
A 或 ;B C
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡。当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的KW相似)。如:
AgX(s) Ag++X-,Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
Ag++X-,Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
AgY(s)  Ag++Y-,Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
Ag++Y-,Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s)  Ag++Z-,Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
Ag++Z-,Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
下列说法错误的是( )
A.这三种物质在常温下溶解度最大的是AgZ
B.将AgY溶解于水后,向其中加入AgX,则c(Y-)减小
C.在25℃时,取0.188 g AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中c(Y-)=1.0×10-4 mol/L
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
请回答下列问题:
(1)31Ga基态原子的核外电子排布式是________________。某种半导体材料由Ga和As两种元素组成,该半导体材料的化学式是________,其晶体结构类型可能为________。
(2)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为

以下关于维生素B1的说法正确的是________。
A.只含σ键和π键
B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl
D.该物质易溶于盐酸
(3)维生素B1晶体溶于水的过程中要克服的微粒间的作用力有________。
A.离子键、共价键
B.离子键、氢键、共价键
C.氢键、范德华力
D.离子键、氢键、范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是( )
A.SiX4难水解
B.SiX4是共价化合物
C.NaX易水解
D.NaX的熔点一般高于SiX4
Ⅱ.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

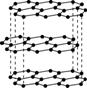

C60 石墨 金刚石晶胞
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为________________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在________共价键,还有________键。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=____________a,列式表示碳原子在晶胞中的空间占有率____________________(不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.工业上用电解熔融氯化钠的方法制取钠
B.钠加入氯化镁的饱和溶液中可以制取金属镁
C.电解冶炼铝的原料是氯化铝
D.电解氯化镁溶液来制取镁
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A+3B=4C+2D,在不同条件下反应,其平均反应速率v(X)(表示反应物的消耗速率或生成物的生成速率)如下,其中反应速率最快的是
A.v(A)=0.4mol/(L·s) B.v(B)=0.8mol/(L·s)
C.v(C)=1.2mol/(L·s) D.v(D)=0.7mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
环保部制定的《环境空气质量标准》第二次公开征求意见结束,大家普遍赞成将PM2.5(PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物)纳入常规空气质量评价,下列有关PM2.5说法不正确的是
A.PM2.5表面积大能吸附大量的有毒、有害物质
B.PM2.5在空气中形成气溶胶
C.实施绿化工程,可以有效地防治PM2.5污染
D.研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反 应方程式:__________________________________________________。
应方程式:__________________________________________________。
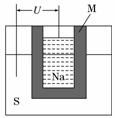 (2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS===Na2Sx,正极的电极反应式为____________。M(由Na2O和Al2O3制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS===Na2Sx,正极的电极反应式为____________。M(由Na2O和Al2O3制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(3)以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为________________________________,正极的反应式为________________。理想状态下,该燃料电池消耗1 mol 甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为ΔH=-726.5 kJ/mol)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com