
【题目】Ⅰ.(多选)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是(____)
A.SiX4难水解 B.SiX4是共价化合物
C.NaX易水解 D.NaX的熔点一般高于SiX4
Ⅱ.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
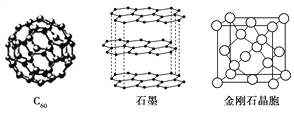
回答下列问题:
(1)金刚石、石墨、C60和碳纳米管等都是碳元素的单质形式,它们互为________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在________共价键,还有________键。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=________a,列式表示碳原子在晶胞中的空间占有率________(不要求计算结果)。
【答案】 BD 同素异形体 sp3 sp2 分子 混合 σ键 σ键 π键(或大π键或p-pπ键) 8 ![]()
![]() =
=![]()
【解析】Ⅰ.SiX4易水解生成硅酸和卤化氢,A错误;SiX4只含有共价键,是共价化合物, B正确;NaX是离子化合物,阴、阳离子不易水解,C错误;NaX是离子化合物,SiX4是共价化合物,NaX的熔点高,D正确;正确选项BD。
Ⅱ.(1)金刚石、石墨、C60和碳纳米管等都是碳元素的单质形式,它们互为同素异形体;正确答案:同素异形体。
(2)根据晶胞图中可知:金刚石中碳原子形成4条共价键,为sp3杂化; 石墨烯为片层结构,碳原子以sp2杂化;正确答案:. sp3;sp2 。
(3)C60只含有共价键,属于分子晶体;石墨既含有共价键,又含有分子间作用力,属于混合晶体;正确答案:分子; 混合。
(4)金刚石中只存在C—C间的σ共价键,而石墨层内的C—C间存在σ共价键和π键,键能大,键长变小;正确答案:σ键;σ键; π键(或大π键或p-pπ键)。
(5)金刚石晶胞中含有碳原子数为8×1/8+6×1/2+4=8,金刚石不是紧密堆积结构,设体心有一个球,沿体对角线方向有5个球,体对角线距离为8r=a×√3, a=8r/√3,原子的体积V(原子)=4/3πr3×8=32πr3/3,晶胞的体积 V(晶胞)= a3=(8r/√3)3,空间占有率= V(原子)/ V(晶胞)= √3π/16;正确答案:8; ![]() ;
;![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Fe3+、Cl-、SO42-四种离子,已知Na+、Fe3+、Cl-的个数比为3∶2∶1。则溶液中Fe3+和SO42-的个数比为
A. 1∶2 B. 1∶4 C. 3∶4 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水中,水分子可彼此通过氢键形成(H2O)n的小集团。在一定温度下(H2O)n的n=5,每个水分子被4个水分子包围着形成四面体。(H2O)n的n=5时,下列说法中正确的是 ( )
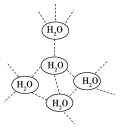
A.(H2O)n是一种新的水分子
B.(H2O)n仍保留着水的化学性质
C.1 mol(H2O)n中有2个氢键
D.1 mol(H2O)n中有4 mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg。下列说法正确的是

A. Pt上发生氧化反应
B. Pb上发生的电极反应式为Pb-2e-+2OH-=Pb(OH)2
C. 反应过程中转移OH-的物质的量为0.25bmol
D. 待测气体中氧气的体积分数为0.7b/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、C1-等形成配位数为4的配合物。
(1)[Cu(NH3)4]2+中存在的化学键类型有____(填序号)。
A.配位链 B.极性共价键 C.非极性共价键 D.离子键
(2)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________________________________。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2![]() CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。
CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q为短周期非金属元素,R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+只有三个电子层且完全充满电子。请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为 。
(2)X、Y、Z三种元素第一电离能从大到小顺序为 。
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):
![]()
①该分子中两个Y原子之间的键型组合正确的是 。
A.仅1个σ键
B.1个σ键和2个π键
C.1个σ键和1个π键
D.仅2个σ键
②该分子中Y原子的杂化方式是 。
(4)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 。

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验是化学中的基础实验,请回答有关问题。
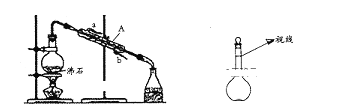
(1)用四氯化碳提取溴水中的溴,所用的分离方法是______,用到的主要仪器是______________,
(2)用图装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有_____,实验时仪器A中冷却水的进口为_______________(选填“a”或“b)
(3)实验室需配制100mL 3.6mol·L—1的稀硫酸。若采用18 mol·L—1的浓硫酸来配制稀硫酸需要用到浓硫酸的体积为_____________,实验中将溶液转移到容量瓶中的正确操作是_________________________。在稀硫酸配制过程中,某同学观察液面的情况如图所示,所配稀硫酸的浓度会____________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Mg及其化合物在生产、生活中有着广泛的应用,请按要求回答下列问题。
I. 用废铝渣制备Al(OH)3的流程如下图所示,假设反应①杂质不反应。

(1)Al在元素周期表中的位置为______,试剂X的名称______ 。
(2)溶液A显酸性的原因可能是(可用离子方程式表示) a.盐酸过量;b. ____________。
II.用镁硅酸盐矿石制备高纯度Mg(OH)2的流程如下图所示:
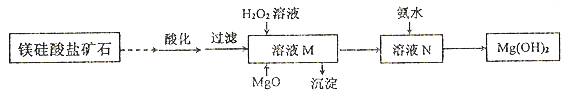
已知:①溶液M中除含Mg2+、SO42-外,还含少量Fe3+、 Al3+、Fe2+等离子;
②Mg2+与氨水的反应为吸热反应。
(1)向溶液M中先加入的试剂是_______;产生的沉淀有_____。H2O2参与反应的离子方程式是____________________。
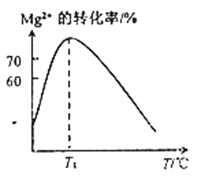
(2)溶液N中Mg2+的装化率随温度T的变化情况如图所示。T1之后,Mg,2+的转化率减小的原因是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com