
下面是某化 学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
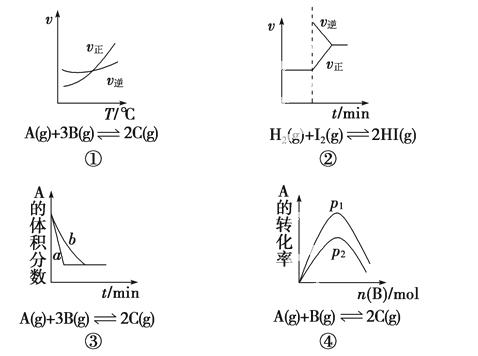
A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B.②是缩小容积体积后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法正确的是( )
A.福尔马林可用于保存海鲜产品[ B.鸡蛋清中加入CuSO4溶液会发生变性
C.合成橡胶与光导纤维都属于有机高分子材料
D.丝绸和棉花的组成元素相同,分子结构不同,因而性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质的成分。
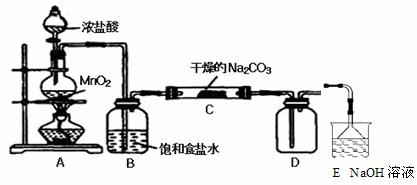
向C装置中通入一定量的氯气后,测得只生成一种气体Cl2O。可以确定的是C得到的固体最多含有三种物质,含有氯元素的盐只有一种,且一定含有NaHCO3,现对C中得到的固体成分进行猜想和验证。
①提出合理猜想:一定含有NaHCO3和 ;可能含有剩余的Na2CO3。
②设计方案,进行成分检验:
请完成实验步骤3、4以及预期现象和结论并将答案填入下表的相应空格内。
限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于甲、乙两支试管中。 | 得到无色溶液 |
| 步骤2:向甲试管中加入过量的BaCl2溶液,静置。 | 若溶液变浑浊,证明固体中含有 。 |
| 步骤3:取甲试管中上层清液少许于另一只试管中,滴加少量 ,充分振荡。 | 若 , 证明固体中含有NaHCO3 。 |
| 步骤4:向乙试管中先加入过量的 , 再滴入少量 溶液。 | 若生成白色沉淀;证明固体中含有______。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
果汁在生产过程中添加亚硫酸及其盐类,以抑制有害微生物的生长及抗氧化。某化学兴趣小组查阅文献后,用下图所示装置测定某果汁样品中SO2残留量。
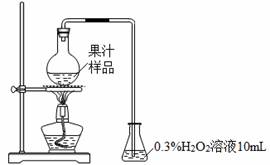
实验步骤:
(ⅰ)在烧瓶中加入50.00 mL果汁样品与3mL浓硫酸的混合液,加热10 min。
(ⅱ)移出锥形瓶,迅速滴入2~3滴酚酞试液,用0.01000 mol·L-1NaOH标准溶液滴定。
回答问题:
(1)实验室配制NaOH标准溶液时,不需要用到的仪器是 。
A.容量瓶 B.胶头滴管 C.烧瓶 D.玻璃棒
(2)将50. 00 mL果汁样品与3mL浓硫酸混合的操作是 。
(3)锥形瓶中发生反应的离子方程式是 。
(4)若步骤(ⅱ)消耗NaOH标准溶液25. 00 mL,则果汁样品中SO2残留量是 g/L。
(5)若改用0.5%的碘水10 mL作吸收液,实验中消耗NaOH标准溶液体积 。
A.V = 25 mL B.25 mL<V<50 mL C.V>50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
| t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为________________________________________________。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K________1.0(填“大于”、“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为____________(填“正反 应方向”、“逆反应方向”或“不移动”)。
应方向”、“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)  2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
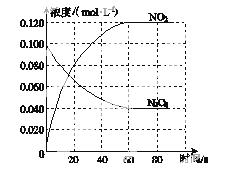
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4 )以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某化学反应的平衡常数表达式为K= ,在不同的温度下该反应的平衡常数如下表:
,在不同的温度下该反应的平衡常数如下表:
| t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是 ( )。
A.该反应的化学方程式是CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.若平衡浓度符合关系式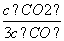 =
=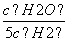 ,则此时的温度为1 000 ℃
,则此时的温度为1 000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
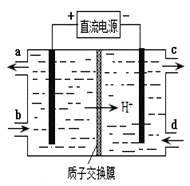
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
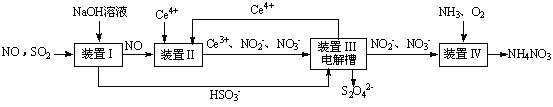
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
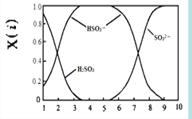
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
在粗盐提纯的实验中,蒸发时正确的操作是:
A.把浑浊的液体倒入蒸发皿内加热 B.开始析出晶体后用玻璃棒搅拌
C.待水分完全蒸干后停止加热 D.蒸发皿中出现大量固体时即停止加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com