
【题目】下列有关电解质溶液的说法正确的是( )
A. 10mL0.1mol·L-1Na2CO3溶液逐滴滴加到10mL0.1mol·L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
B. NH4HCO3溶液中存在:C(NH4+)=C(HCO3-)+C(CO32-)+C(H2CO3)
C. 常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=3.6×10-10
D. 若两种盐溶液的浓度相同且pH(NaX)>pH(NaY),则c(X-)+c(OH-)<c(Y-)+c(OH-)
【答案】D
【解析】分析:A中考察碳酸钠溶液滴加到盐酸中生成氯化钠和二氧化碳;B中主要考察水解的盐溶液中存在的物料守恒规律,注意铵根离子、碳酸氢根离子均能发生水解;C中先计算出亚硫酸根离子的水解平衡常数,再计算出溶液中钙离子和亚硫酸根离子浓度,然后根据Ksp(CaSO3)进行近似计算;D根据两种盐的水解程度不同,水解能力强的,溶液的碱性强,氢离子浓度小,然后利用电荷守恒规律进行解析。
详解:10mL0.1mol·L-1Na2CO3溶液逐滴滴加到10mL0.1mol·L-1盐酸中,开始时产生二氧化碳气体,滴加完毕后盐酸完全反应,碳酸钠过量,所以得到碳酸钠和氯化钠的混合物,所以离子浓度大小为: c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-),A错误;由于铵根离子、碳酸氢根离子均发生水解,因此根据物料守恒规律可知;c(NH3H2O)+c(NH4+)=c(HCO3-)+c(CO32-)+c(H2CO3), B错误;常温下,测得某纯CaSO3与水形成的浊液pH为9,由CaSO3(s)![]() Ca2+(aq)+SO32-(aq),且SO32-+H2O
Ca2+(aq)+SO32-(aq),且SO32-+H2O![]() HSO3-+OH-,得c(HSO3-)=c(OH-)=1×10-5mol· L-1,Ka2(H2SO3)=6.0×10-9,可知SO32-+H2O
HSO3-+OH-,得c(HSO3-)=c(OH-)=1×10-5mol· L-1,Ka2(H2SO3)=6.0×10-9,可知SO32-+H2O![]() HSO3-+OH-的水解常数Kh=10-14/6.0×10-9=1.67×10-6,以此计算c(SO32-)=(1×10-5)2/1.67×10-6 =6×10-5mol· L-1,溶液中c(Ca2+)≈c(SO32-)+c(HSO3-)=7×10-5mol· L-1,Ksp(CaSO3)=c(Ca2+)·c(SO32-)=7×10-5×6×10-5=4.2×10-9, C错误;若两种盐溶液的浓度相同且pH(NaX)>pH(NaY),说明NaX水解能力强于NaY,碱性:NaX>NaY,所以 NaX溶液中c(H+)小于NaY溶液中 c(H+),根据电荷守恒关系:c(X-)+c(OH-)= c(H+)+ c(Na+), c(Y-)+c(OH-)= c(H+)+ c(Na+)可知,两溶液中c(Na+)相等,所以c(X-)+c(OH-)<c(Y-)+c(OH-),D正确;正确选项D。
HSO3-+OH-的水解常数Kh=10-14/6.0×10-9=1.67×10-6,以此计算c(SO32-)=(1×10-5)2/1.67×10-6 =6×10-5mol· L-1,溶液中c(Ca2+)≈c(SO32-)+c(HSO3-)=7×10-5mol· L-1,Ksp(CaSO3)=c(Ca2+)·c(SO32-)=7×10-5×6×10-5=4.2×10-9, C错误;若两种盐溶液的浓度相同且pH(NaX)>pH(NaY),说明NaX水解能力强于NaY,碱性:NaX>NaY,所以 NaX溶液中c(H+)小于NaY溶液中 c(H+),根据电荷守恒关系:c(X-)+c(OH-)= c(H+)+ c(Na+), c(Y-)+c(OH-)= c(H+)+ c(Na+)可知,两溶液中c(Na+)相等,所以c(X-)+c(OH-)<c(Y-)+c(OH-),D正确;正确选项D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备较为纯净的Fe2O3,其反应方程式为:2FeSO4 ![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
为了检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,先加入一定量稀盐酸使固体完全溶解,再向所得溶液中适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入如图所示的装置中,以检验产生的气体中是否含有SO2 和SO3
请回答下列问题:
(1)写出能说明FeSO4发生分解的现象__________________________________;
(2)写出KSCN溶液与Fe3+反应的离子方程式:_________________;
(3)实验②中,气体通过BaCl2时可以观察到的现象__________________________,产生该现象所对应的化学反应为___________________________________(用一个化学反应方程式表示);
(4)实验②中最后要将通过品红溶液的气体通入NaOH溶液中,其目的是________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B. 将体积增大为原来的2倍,再次达到平衡时,气体的密度变大
C. 因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以是△H<0
D. 保持容器压强不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。

仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。

(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。

(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T—细胞淋巴瘤,其合成路线如下图所示:
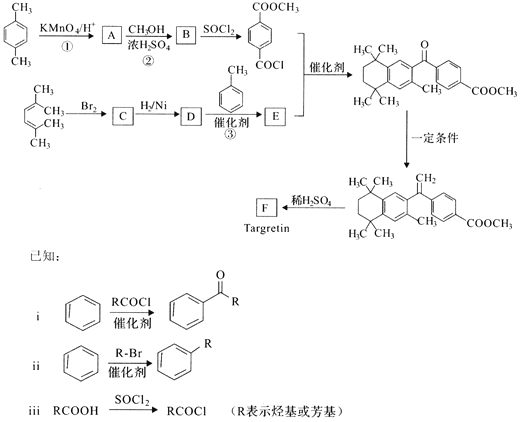
(1)反应①的反应类型是______________。
(2)反应②的化学方程式:__________________________________________。
(3)C的核磁共振氢谱图中有______________个峰。
(4)反应③的化学方程式:__________________________________________。
(5)F的分子式是C24H28O2. F中含有的官能团:__________________________。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑—O—O—或![]() 结构):_______________________________________________________________。
结构):_______________________________________________________________。
a.苯环上的一氯代物有两种 b.既能发生银镜反应又能发生水解反应
(7)已知:![]() 。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() 合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为三套实验装置。
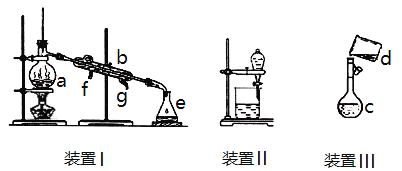
(1)写出下列仪器的名称:a.___________________b.____________________。
(2)若利用装置I分离四氯化碳和酒精的混合物,冷凝水由_____(填f或g)口通入。
(3)用装置II分离混合物时,为使液体顺利流下,应进行的操作是_____________。
(4)实验室用Na2CO3·10H2O晶体配制0.05mol/L的Na2CO3溶液970mL。
①应用托盘天平称取Na2CO3·10H2O的质量是_____________g。
②装置III是某同学转移溶液的示意图。图中的错误是___________________。
(5)定容时,俯视刻度线,对所配溶液浓度的影响:_____________(填:偏大、偏小、或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。

(1)图甲中,1号C与相邻C形成σ键的个数为__________。
(2)图乙中,1号C的杂化方式是__________,该C与相邻C形成的键角__________(填“>”、“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为____________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

①“可燃冰”中分子间存在的2种作用力是___________________________;
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想的依据是:______________________________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态铜原子的电子排布式为_____________;已知高温下CuO![]() Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________________________。
Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________________________。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的最简单的氢化物中,分子构型分别为____________, 若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____Si (填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_____________________________________________。

(3)与铟、镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤电子对的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______, B与N之间形成___________键。
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如下图所示,则金刚砂晶体类型为_________________,在SiC中,每个C原子周围最近的C原子数目为___个;若晶胞的边长为a pm,则金刚砂的密度为____g/cm3 (用NA表示阿伏伽德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
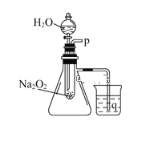
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是:a.有氧气生成;b.___________。Na2O2和H2O反应的化学方程式是____________。
(2)某研究性学习小组拟用如图套管装置进行实验,以证明上述结论。
①用以验证结论a的实验方法是__________________________。
②用以验证结论b的实验方法及现象是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com