考点:等效平衡,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(2)①依据平衡常数随温度变化分析,结合平衡移动原理分析热量变化;
②依据化学平衡的三段式列式计算,依据转化率概念计算得到;根据浓度计算出平衡常数,再判断温度;
(3)增大压强,平衡正向移动;甲醇的体积分数(φ)增大;升高温度,平衡逆向移动,甲醇的体积分数(φ)减小,依此作图;
(4)a.升温,反应速率加快,平衡逆向移动,CO的转化率减小;
b.加入催化剂,反应速率加快,平衡不移动,CO的转化率不变;
c.增加CO的浓度,反应速率加快,平衡正向移动,但CO的转化率减小;
d.通入H
2加压,反应速率加快,平衡正向移动,CO的转化率增大;
e.通人惰性气体加压,反应速率不变,平衡不移动,CO的转化率不变;
f.分离出甲醇,反应速率减慢,平衡正向移动,CO的转化率增大;
(5)A.甲、丙相比较,把甲等效为开始加入1molCH
3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH
3OH(g)?CO(g)+2H
2(g),平衡向生成甲醇的方向移动;
B.由题目可知生成1molCH
3OH的能量变化为
=90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,计算反应热数值,据此判断;
C.比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH
3OH(g)?CO(g)+2H
2(g),平衡向生成甲醇的方向移动;
D.甲、乙处于相同的平衡状态,则α
1+α
2=1,由C的分析可知α
2>α
3,据此判断.
解答:
解:(1)CO(g)+2H
2(g)?CH
3OH(g)
a.生成CH
3OH是正反应,消耗CO也是正反应,故a错误;
b.密度=
,总质量一定,体积一定,故混合气体的密度不变不能说明反应达平衡状态,故b错误;
c.达到化学平衡状态时,各物质的浓度不再发生变化,故CH
3OH、CO、H
2的浓度都不再发生变化能说明反应达平衡状态,故c正确;
d.平均相对分子质量=
,总质量一定,总物质的量会变,故混合气体的平均相对分子质量不变能说明反应达平衡状态,故d正确;
故答案为:cd;
(2)①依据图表数据可知,随温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,故Q<0;
故答案为:<;
△G=△H-T△S,△H<0,△S<0,故低温有利于自发进行,
故答案为:<;低温;
②c(CO)=0.2mol/L,物质的量为0.4mol;
CO (g)+2H
2 (g)?CH
3OH (g)
起始量(mol) 2 6 0
变化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
c(CO)=
=0.2mol/L,c(H
2)=
=1.4mol/L,c(CH
3OH )=
=0.8mol/L,
此时的平衡常数为:K=
≈2.041,所以温度为250℃,
CO的转化率=
×100%=80%,
故答案为:250℃;80%;
(3)增大压强,平衡正向移动;甲醇的体积分数(φ)增大;升高温度,平衡逆向移动,甲醇的体积分数(φ)减小,
故答案为:

;
(4)a.升温,反应速率加快,平衡逆向移动,CO的转化率减小,故a错误;
b.加入催化剂,反应速率加快,平衡不移动,CO的转化率不变,故b错误;
c.增加CO的浓度,反应速率加快,平衡正向移动,但CO的转化率减小,故c错误;
d.通入H
2加压,反应速率加快,平衡正向移动,CO的转化率增大,故d正确;
e.通人惰性气体加压,反应速率不变,平衡不移动,CO的转化率不变,故e错误;
f.分离出甲醇,反应速率减慢,平衡正向移动,CO的转化率增大,故f错误;
故答案为:d;
(5)A.甲、丙相比较,把甲等效为开始加入1molCH
3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH
3OH(g)?CO(g)+2H
2(g),平衡向生成甲醇的方向移动,故2c
1<c
3,故A错误;
B.由题目可知生成1molCH
3OH的能量变化为
=90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1-n),故a+b=90.8,故B错误;
C.比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH
3OH(g)?CO(g)+2H
2(g),平衡向生成甲醇的方向移动,故2p
2>p
3,故C错误;
D.甲、乙处于相同的平衡状态,则α
1+α
2=1,由C的分析可知α
2>α
3,所以a
1+a
3<1,故D正确,
故答案为:D.
点评:本题考查平衡状态的判断、化学平衡的计算、平衡常数的计算等,综合性较强,难度中等,题量超大.

 工业上在合成塔中采用下列反应合成甲醇:
工业上在合成塔中采用下列反应合成甲醇: ;
;

 请写出图示燃料电池的反应式:
请写出图示燃料电池的反应式: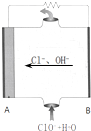 镁燃料电池具有高比能量、安全和成本低等特点,在军事和民用方面有良好的应用前景.镁燃料电池的氧化剂可以利用空气或者海水中的氧,还有过氧化氢和次氯酸盐等.
镁燃料电池具有高比能量、安全和成本低等特点,在军事和民用方面有良好的应用前景.镁燃料电池的氧化剂可以利用空气或者海水中的氧,还有过氧化氢和次氯酸盐等.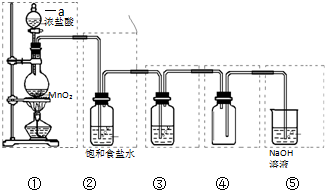 如图是实验室制取 氯气的实验装置.
如图是实验室制取 氯气的实验装置.