
科目:高中化学 来源: 题型:阅读理解

| 实验小组 | 称取CuSO4 的质量(g) |
装置C增加 的质量(g) |
量筒中水的体积折算成标 准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 298.7 |
| 二 | 6.4 | 2.56 | 448 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
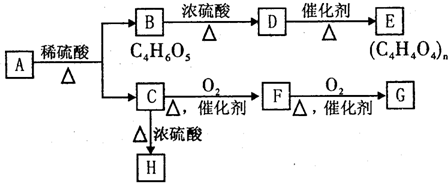
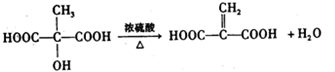
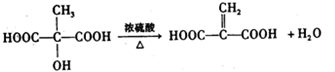




查看答案和解析>>
科目:高中化学 来源: 题型:
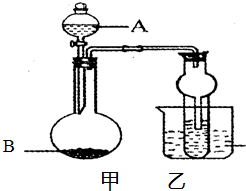 某同学设计如图所示的装置进行实验,请回答:
某同学设计如图所示的装置进行实验,请回答:| 编号 | 液体A | 固体B | 可制得的气体 |
| ① | 浓氨水 | NaOH | NH3 |
| ② | 稀硫酸 | Zn | H2 |
| ③ | 稀盐酸 | CaC03 | C02 |
| ④ | 双氧水 | Mn02 | Q |
| ⑤ |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省青岛市高三自评(二模)化学试卷(解析版) 题型:计算题
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 _____;
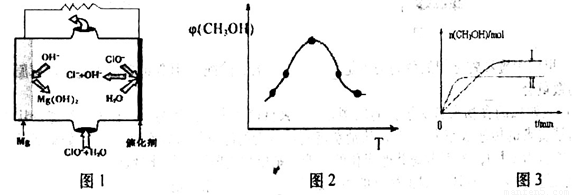
②由MgO可制成“镁——次氯酸盐”电池,其装置示意图如图1,该电池正极的电极反应式为_________;
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)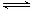 CH3OH(g)
△H=QkJ/mol
CH3OH(g)
△H=QkJ/mol
①该反应的平衡常数表达式为K=_______。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中发生上述反应,反应相同时间后测得甲醇的体积分数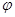 ( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);
( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);
③在其中两个容器中,测得CH3OH的物质的量随时间变化如图3所示,曲线I、II对应的平衡常数大小关系为K1_________K11(填“>”“<”或“=”)。
(3)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H=-180.5kJ/mol
2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com